Aktiviti 7.1:
Tujuan: Mengukur masa tindak balas berdasarkan beberapa perubahan yang boleh diperhatikan dan diukur.
Bahan: Serbuk zink, Zn, asid sulfurik, H2SO4 0.1 mol dm–3, ketulan marmar, CaCO3 , asid nitrik, HNO3 2.0 mol dm–3, serbuk kalium iodida, KI, serbuk plumbum(II) nitrat, Pb(NO3)2 dan air suling
Radas: Kaki retort dan pengapit, buret, besen, kelalang kon 250 cm3, silinder penyukat 10 cm3 dan 100 cm3, penyumbat getah, salur penghantar, penimbang elektronik, jam randik, kapas, piring Petri, botol penimbang, corong turas, pembaris dan kertas turas
(A) Tindak balas antara zink, Zn dan asid sulfurik, H2SO4
Prosedur:
1. Masukkan 20.0 cm3 asid sulfurik, H2SO4 0.1 mol dm–3 ke dalam sebuah kelalang kon.
2. Penuhkan buret dengan air dan telangkupkannya ke dalam sebuah besen yang berisi air.
Apitkan buret secara menegak.
3. Laraskan aras air di dalam buret supaya bacaan aras air ialah 50.00 cm3.
4. Sediakan radas seperti dalam Rajah 7.2.
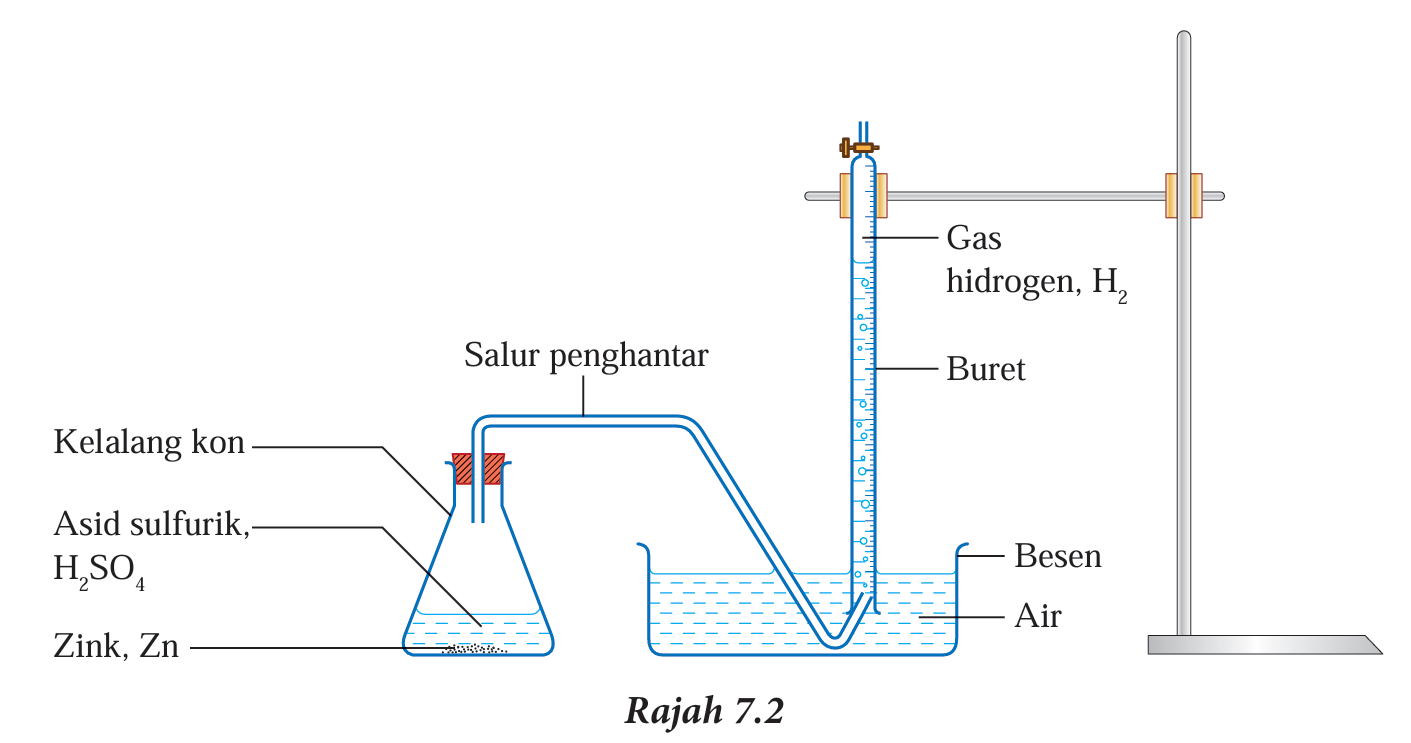
5. Masukkan 5.0 g serbuk zink, Zn ke dalam kelalang kon yang berisi asid sulfurik, H2SO4.
6. Dengan serta-merta, tutupkan kelalang kon dengan penyumbat getah yang bersambung dengan salur penghantar dan mulakan jam randik.
7. Catatkan bacaan buret pada setiap selang masa 0.5 minit selama 5 minit.
8. Rekod keputusan anda dalam jadual seperti Jadual 7.1.
Keputusan:

Perbincangan:
1. Nyatakan perubahan yang diperhatikan dan diukur dalam aktiviti ini.
2. Namakan gas yang terbebas.
3. Tulis persamaan kimia bagi tindak balas yang berlaku.
4. Bagaimanakah anda tahu tindak balas telah selesai?
(B) Tindak balas antara asid nitrik, HNO3 dan ketulan marmar, CaCO3
Prosedur:
1. Masukkan 100.0 cm3 asid nitrik, HNO3 2.0 mol dm–3 ke dalam sebuah kelalang kon.
2. Tutupkan kelalang kon dengan kapas secara longgar.
3. Sediakan radas seperti dalam Rajah 7.3.
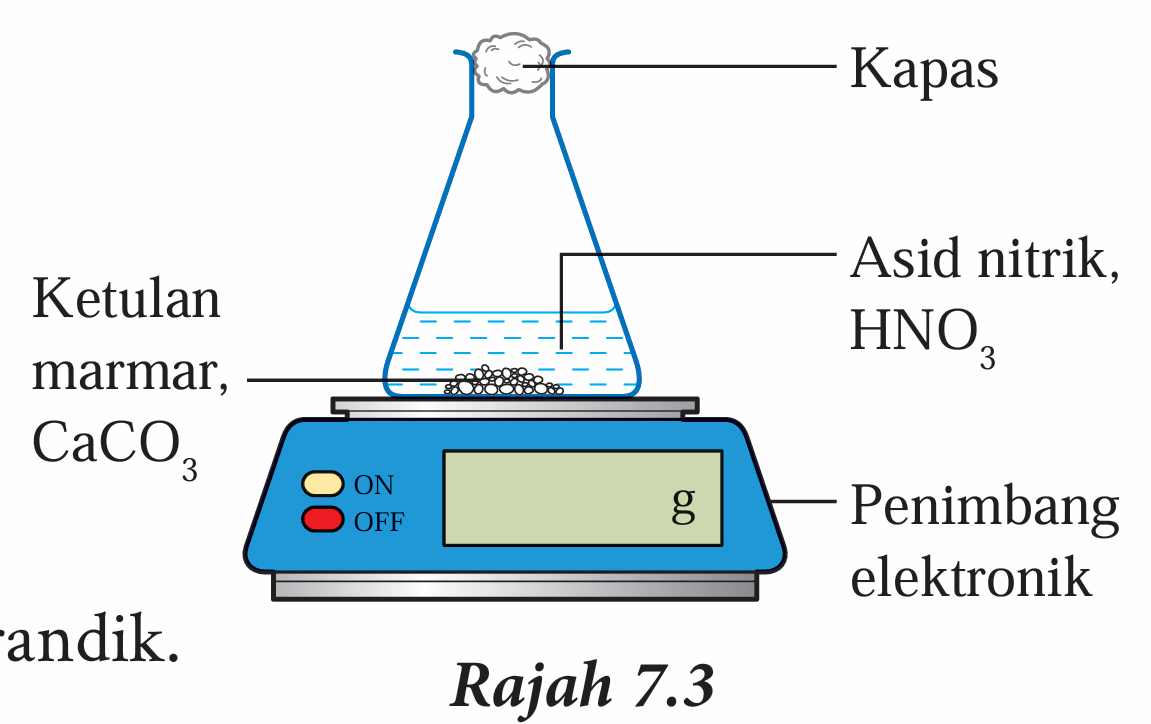
4. Masukkan 10.0 g ketulan marmar, CaCO3 ke dalam kelalang kon.
5. Dengan cepat, tutupkan kelalang kon dan mulakan jam randik.
6. Catatkan bacaan penimbang pada setiap selang masa 30 saat.
7. Perhatikan perubahan dalam kelalang kon dan rekod semua pemerhatian.
8. Rekod data anda dalam bentuk jadual.
Perbincangan:
1. Nyatakan perubahan yang diperhatikan dan diukur dalam aktiviti ini.
2. Mengapakah perubahan tersebut berlaku? Jelaskan jawapan anda dengan bantuan persamaan kimia yang sesuai.
3. Bagaimanakah anda tahu tindak balas telah selesai?
(C) Tindak balas antara larutan kalium iodida, KI dan larutan plumbum(II) nitrat, Pb(NO3)2
Prosedur:
1. Timbangkan 2.0 g serbuk kalium iodida, KI dan 2.0 g serbuk plumbum(II) nitrat, Pb(NO3)2 di dalam dua botol penimbang secara berasingan.
2. Tuangkan air suling ke dalam piring Petri sedalam 0.5 cm.
3. Letakkan serbuk kalium iodida, KI di dalam air di bahagian tepi piring Petri.
4. Letakkan serbuk plumbum(II) nitrat, Pb(NO3)2 di bahagian bertentangan dengan serbuk kalium iodida, KI seperti dalam Rajah 7.4.
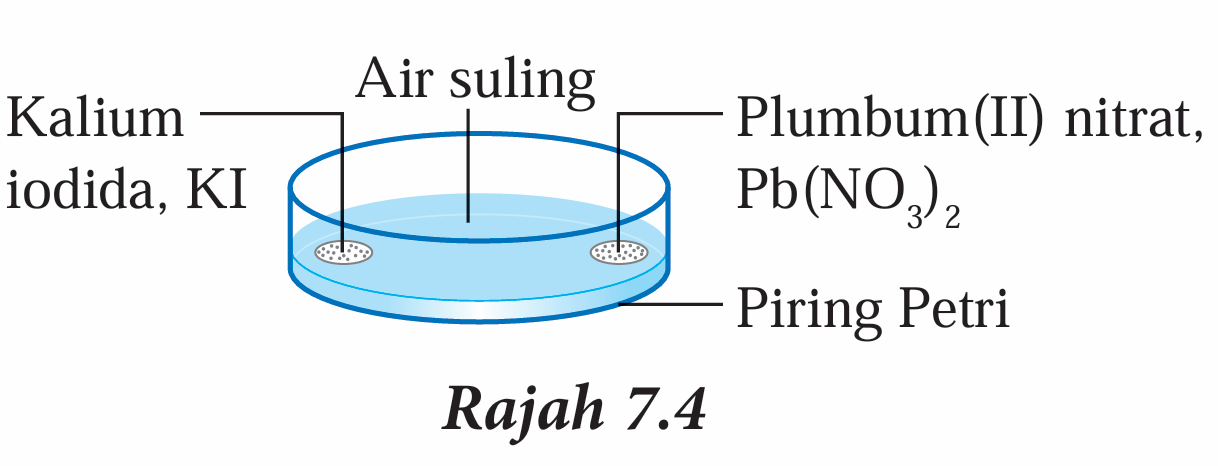
5. Dengan serta-merta, mulakan jam randik.
6. Rekod masa untuk tindak balas selesai, iaitu tiada pembentukan mendakan lagi.
7. Turaskan kandungan di dalam piring Petri dan cucikan mendakan dengan air suling.
8. Keringkan mendakan dan timbangkannya.
9. Rekod data anda dalam bentuk jadual.
Perbincangan:
1. Apakah warna mendakan yang terbentuk?
2. Tulis persamaan kimia bagi tindak balas yang berlaku.
Jawapan:
(A) Tindak balas antara zink, Zn dan asid sulfurik, H2SO4
Perbincangan:
1. Pembuakan / Gelembung gas terbentuk. Isi padu gas terbentuk dapat diukur.
2. Gas hidrogen
3. Zn(p) + H2SO4(ak) ⟶ ZnSO4(ak) + H2(g)
4. Pembuakan berhenti / Tiada gelembung gas terbebas
(B) Tindak balas antara asid nitrik, HNO3 dan ketulan marmar, CaCO3
Perbincangan:
1. Pengurangan jisim marmar, CaCO3 (bacaan penimbang berkurang).
2. Kehilangan gas karbon dioksida yang terhasil.
CaCO3(p) + 2HNO3(ak) ⟶ Ca(NO3)2(ak) + H2O(ce) + CO2(g)
3. Pembuakan berhenti / Tiada gelembung gas terbebas / Tiada perubahan jisim
(C) Tindak balas antara larutan kalium iodida, KI dan larutan plumbum(II) nitrat, Pb(NO3)2
Perbincangan:
1. Mendakan kuning
2. Pb(NO3)2(ak) + 2KI(ak) ⟶ PbI2(p) + 2KNO3(ak)
Tujuan: Mengukur masa tindak balas berdasarkan beberapa perubahan yang boleh diperhatikan dan diukur.
Bahan: Serbuk zink, Zn, asid sulfurik, H2SO4 0.1 mol dm–3, ketulan marmar, CaCO3 , asid nitrik, HNO3 2.0 mol dm–3, serbuk kalium iodida, KI, serbuk plumbum(II) nitrat, Pb(NO3)2 dan air suling
Radas: Kaki retort dan pengapit, buret, besen, kelalang kon 250 cm3, silinder penyukat 10 cm3 dan 100 cm3, penyumbat getah, salur penghantar, penimbang elektronik, jam randik, kapas, piring Petri, botol penimbang, corong turas, pembaris dan kertas turas
(A) Tindak balas antara zink, Zn dan asid sulfurik, H2SO4
Prosedur:
1. Masukkan 20.0 cm3 asid sulfurik, H2SO4 0.1 mol dm–3 ke dalam sebuah kelalang kon.
2. Penuhkan buret dengan air dan telangkupkannya ke dalam sebuah besen yang berisi air.
Apitkan buret secara menegak.
3. Laraskan aras air di dalam buret supaya bacaan aras air ialah 50.00 cm3.
4. Sediakan radas seperti dalam Rajah 7.2.

5. Masukkan 5.0 g serbuk zink, Zn ke dalam kelalang kon yang berisi asid sulfurik, H2SO4.
6. Dengan serta-merta, tutupkan kelalang kon dengan penyumbat getah yang bersambung dengan salur penghantar dan mulakan jam randik.
7. Catatkan bacaan buret pada setiap selang masa 0.5 minit selama 5 minit.
8. Rekod keputusan anda dalam jadual seperti Jadual 7.1.
Keputusan:

Perbincangan:
1. Nyatakan perubahan yang diperhatikan dan diukur dalam aktiviti ini.
2. Namakan gas yang terbebas.
3. Tulis persamaan kimia bagi tindak balas yang berlaku.
4. Bagaimanakah anda tahu tindak balas telah selesai?
(B) Tindak balas antara asid nitrik, HNO3 dan ketulan marmar, CaCO3
Prosedur:
1. Masukkan 100.0 cm3 asid nitrik, HNO3 2.0 mol dm–3 ke dalam sebuah kelalang kon.
2. Tutupkan kelalang kon dengan kapas secara longgar.
3. Sediakan radas seperti dalam Rajah 7.3.

4. Masukkan 10.0 g ketulan marmar, CaCO3 ke dalam kelalang kon.
5. Dengan cepat, tutupkan kelalang kon dan mulakan jam randik.
6. Catatkan bacaan penimbang pada setiap selang masa 30 saat.
7. Perhatikan perubahan dalam kelalang kon dan rekod semua pemerhatian.
8. Rekod data anda dalam bentuk jadual.
Perbincangan:
1. Nyatakan perubahan yang diperhatikan dan diukur dalam aktiviti ini.
2. Mengapakah perubahan tersebut berlaku? Jelaskan jawapan anda dengan bantuan persamaan kimia yang sesuai.
3. Bagaimanakah anda tahu tindak balas telah selesai?
(C) Tindak balas antara larutan kalium iodida, KI dan larutan plumbum(II) nitrat, Pb(NO3)2
Prosedur:
1. Timbangkan 2.0 g serbuk kalium iodida, KI dan 2.0 g serbuk plumbum(II) nitrat, Pb(NO3)2 di dalam dua botol penimbang secara berasingan.
2. Tuangkan air suling ke dalam piring Petri sedalam 0.5 cm.
3. Letakkan serbuk kalium iodida, KI di dalam air di bahagian tepi piring Petri.
4. Letakkan serbuk plumbum(II) nitrat, Pb(NO3)2 di bahagian bertentangan dengan serbuk kalium iodida, KI seperti dalam Rajah 7.4.

5. Dengan serta-merta, mulakan jam randik.
6. Rekod masa untuk tindak balas selesai, iaitu tiada pembentukan mendakan lagi.
7. Turaskan kandungan di dalam piring Petri dan cucikan mendakan dengan air suling.
8. Keringkan mendakan dan timbangkannya.
9. Rekod data anda dalam bentuk jadual.
Perbincangan:
1. Apakah warna mendakan yang terbentuk?
2. Tulis persamaan kimia bagi tindak balas yang berlaku.
Jawapan:
(A) Tindak balas antara zink, Zn dan asid sulfurik, H2SO4
Perbincangan:
1. Pembuakan / Gelembung gas terbentuk. Isi padu gas terbentuk dapat diukur.
2. Gas hidrogen
3. Zn(p) + H2SO4(ak) ⟶ ZnSO4(ak) + H2(g)
4. Pembuakan berhenti / Tiada gelembung gas terbebas
(B) Tindak balas antara asid nitrik, HNO3 dan ketulan marmar, CaCO3
Perbincangan:
1. Pengurangan jisim marmar, CaCO3 (bacaan penimbang berkurang).
2. Kehilangan gas karbon dioksida yang terhasil.
CaCO3(p) + 2HNO3(ak) ⟶ Ca(NO3)2(ak) + H2O(ce) + CO2(g)
3. Pembuakan berhenti / Tiada gelembung gas terbebas / Tiada perubahan jisim
(C) Tindak balas antara larutan kalium iodida, KI dan larutan plumbum(II) nitrat, Pb(NO3)2
Perbincangan:
1. Mendakan kuning
2. Pb(NO3)2(ak) + 2KI(ak) ⟶ PbI2(p) + 2KNO3(ak)
