Aktiviti Makmal 1D ( Penyesaran Halogen daripada Larutan Halidanya) :
Tujuan : Mengkaji tindak balas redoks dalam penyesaran halogen daripada larutan halidanya.
Bahan : Air klorin, Cl2, air bromin, Br2, larutan iodin, I2, larutan kalium klorida, KCl 0.5 mol dm−3, larutan kalium bromida, KBr 0.5 mol dm−3, larutan kalium iodida, KI 0.5 mol dm−3 dan pelarut organik 1,1,1-trikloroetana, CH3CCl3.
Radas : Tabung uji, silinder penyukat dan rak tabung uji.
Prosedur:
A. Warna halogen di dalam larutan akueus dan pelarut organik 1,1,1-trikloroetana, CH3CCl3
1. Tuangkan 2 cm3 air klorin, Cl2 ke dalam sebuah tabung uji.
2. Tambahkan 2 cm3 pelarut organik 1,1,1-trikloroetana, CH3CCl3, ke dalam tabung uji itu seperti pada Rajah 1.12.
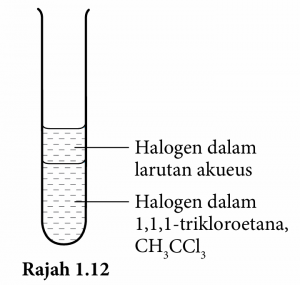
3. Goncangkan campuran dengan kuat dan biarkan tabung uji di rak tabung uji selama 30 saat.
4. Perhatikan dan rekodkan warna lapisan larutan akueus dan lapisan 1,1,1-trikloroetana, CH3CCl3.
5. Ulangi langkah 1 hingga 4 dengan menggunakan air bromin, Br2 dan larutan iodin, I2.
B. Tindak balas penyesaran halogen daripada larutan halidanya
1. Tuangkan 2 cm3 larutan kalium klorida, KCl ke dalam sebuah tabung uji.
2. Tambahkan 2 cm3 air bromin, Br2 ke dalam tabung uji itu.
3. Goncangkan campuran dan perhatikan sebarang perubahan warna yang berlaku.
4. Tambahkan 2 cm3 1,1,1-trikloroetana, CH3CCl3 ke dalam tabung uji itu.
5. Goncangkan campuran dengan kuat dan biarkan selama 30 saat.
6. Perhatikan dan rekodkan warna lapisan akueus dan lapisan 1,1,1-trikloroetana, CH3CCl3.
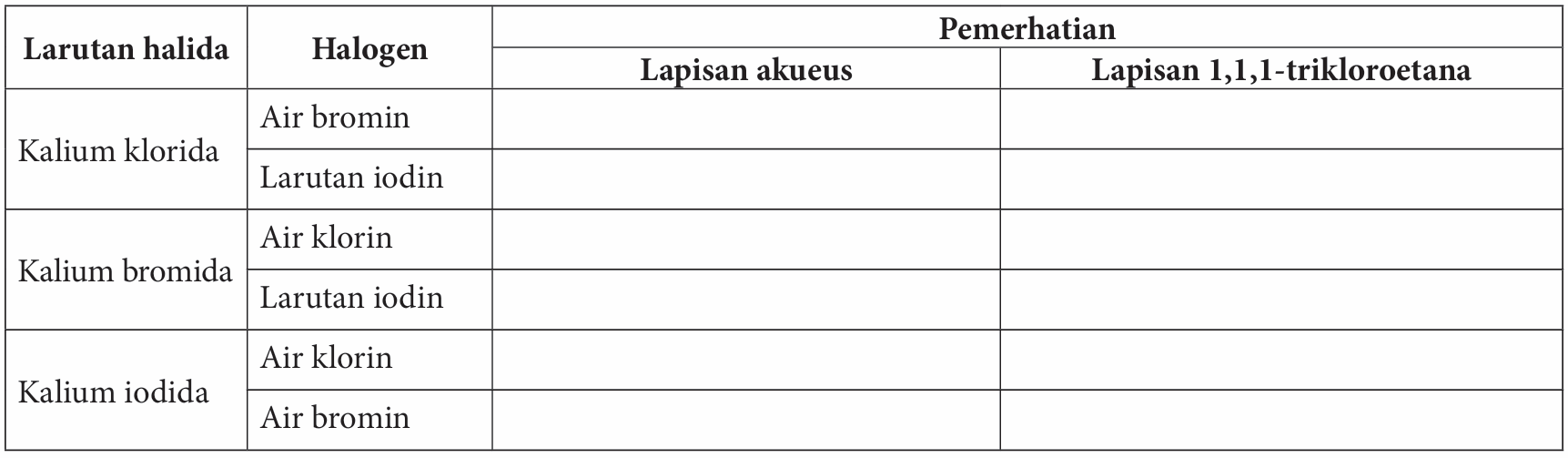
7. Ulangi langkah 1 hingga 6 dengan menggunakan larutan halida dan halogen seperti ditunjukkan dalam jadual yang berikut.

Keputusan:
Sediakan jadual yang sesuai untuk merekodkan semua pemerhatian dalam bahagian A dan bahagian B.
Perbincangan:
1. Apakah fungsi 1,1,1-trikloroetana, CH3CCl3 dalam eksperimen ini?
2. Nyatakan halogen yang dapat;
(a) menyesarkan klorin, Cl2 daripada larutan kalium klorida, KCl,
(b) menyesarkan bromin, Br2 daripada larutan kalium bromida, KBr, dan
(c) menyesarkan iodin, I2 daripada larutan kalium iodida, KI.
3. Bagi setiap tindak balas penyesaran halogen yang berlaku;
(a) tuliskan setengah persamaan pengoksidaan dan setengah persamaan penurunan,
(b) tuliskan persamaan ion keseluruhan bagi tindak balas redoks itu, dan
(c) kenal pasti bahan yang dioksidakan, bahan yang diturunkan, agen pengoksidaan dan agen penurunan. Berikan sebab bagi jawapan anda.
4. Berdasarkan pemerhatian daripada aktiviti makmal ini;
(a) susun klorin, Cl2, bromin, Br2 dan iodin, I2 dari segi kekuatan sebagai agen pengoksidaandalam tertib menaik,
(b) deduksikan hubungan antara kekuatan sesuatu halogen sebagai agen pengoksidaan dengan kedudukan halogen dalam Kumpulan 17, dan
(c) susun ion klorida, Cl−, ion bromida, Br− dan ion iodida, I− berdasarkan kekuatan sebagai agen penurunan dalam tertib menaik.
Jawapan:
Keputusan:
Jadual untuk merekod pemerhatian.
1. Menentusahkan kehadiran suatu halogen.
2.
(a) Tiada
(b) Air klorin.
(c) Air klorin dan air bromin.
3.
KBr dan Cl2
(a)
Setengah persamaan pengoksidaan : 2Br− → Br2 + 2e−
Setengah persamaan penurunan: Cl2 + 2e− → 2Cl−
(b) Persamaan ion keseluruhan: 2Br− + Cl2 → Br2 + 2Cl−
(c)
– Ion Br− dioksidakan kerana ion Br− membebaskan elektron menghasilkan molekul bromin, Br2 manakala klorin diturunkan kerana molekul klorin, Cl2 menerima elektron menghasilkan ion klorida, Cl−
– Air klorin adalah agen pengoksidaan kerana klorin merupakan penerima elektron manakala kalium bromida adalah agen penurunan kerana ion Br− merupakan penderma elektron.
KI dan Cl2
(a)
Setengah persamaan pengoksidaan : 2I− → I2 + 2e−
Setengah persamaan penurunan: Cl2 + 2e− → 2Cl−
(b) Persamaan ion keseluruhan: 2I− + Cl2 → I2 + 2Cl−
(c)
– Ion I− dioksidakan kerana ion I− membebaskan elektron menghasilkan molekul iodin, I2 manakala klorin diturunkan kerana molekul klorin, Cl2 menerima elektron menghasilkan ion klorida, Cl−
– Air klorin adalah agen pengoksidaan kerana klorin merupakan penerima elektron manakala kalium iodida adalah agen penurunan kerana ion I− merupakan penderma elektron.
KI dan Br2
(a)
Setengah persamaan pengoksidaan : 2I− → I2 + 2e−
Setengah persamaan penurunan: Br2 + 2e− → 2Br−
(b) Persamaan ion keseluruhan: 2I− + Br2 → I2 + 2Br−
(c)
– Ion I− dioksidakan kerana ion iodida, I− membebaskan elektron menghasilkan molekul iodin, I2 manakala bromin diturunkan kerana molekul bromin, Br2 menerima elektron menghasilkan ion bromida, Br−.
– Air bromin adalah agen pengoksidaan kerana bromin merupakan penerima elektron manakala kalium iodida adalah agen penurunan kerana ion I− merupakan penderma elektron.
4.
(a) I2, Br2, Cl2
(b) Kekuatan halogen sebagai agen pengoksidaan semakin berkurang apabila menuruni Kumpulan 17.
(c) Cl−, Br−, I−
Tujuan : Mengkaji tindak balas redoks dalam penyesaran halogen daripada larutan halidanya.
Bahan : Air klorin, Cl2, air bromin, Br2, larutan iodin, I2, larutan kalium klorida, KCl 0.5 mol dm−3, larutan kalium bromida, KBr 0.5 mol dm−3, larutan kalium iodida, KI 0.5 mol dm−3 dan pelarut organik 1,1,1-trikloroetana, CH3CCl3.
Radas : Tabung uji, silinder penyukat dan rak tabung uji.
Prosedur:
A. Warna halogen di dalam larutan akueus dan pelarut organik 1,1,1-trikloroetana, CH3CCl3
1. Tuangkan 2 cm3 air klorin, Cl2 ke dalam sebuah tabung uji.
2. Tambahkan 2 cm3 pelarut organik 1,1,1-trikloroetana, CH3CCl3, ke dalam tabung uji itu seperti pada Rajah 1.12.

3. Goncangkan campuran dengan kuat dan biarkan tabung uji di rak tabung uji selama 30 saat.
4. Perhatikan dan rekodkan warna lapisan larutan akueus dan lapisan 1,1,1-trikloroetana, CH3CCl3.
5. Ulangi langkah 1 hingga 4 dengan menggunakan air bromin, Br2 dan larutan iodin, I2.
B. Tindak balas penyesaran halogen daripada larutan halidanya
1. Tuangkan 2 cm3 larutan kalium klorida, KCl ke dalam sebuah tabung uji.
2. Tambahkan 2 cm3 air bromin, Br2 ke dalam tabung uji itu.
3. Goncangkan campuran dan perhatikan sebarang perubahan warna yang berlaku.
4. Tambahkan 2 cm3 1,1,1-trikloroetana, CH3CCl3 ke dalam tabung uji itu.
5. Goncangkan campuran dengan kuat dan biarkan selama 30 saat.
6. Perhatikan dan rekodkan warna lapisan akueus dan lapisan 1,1,1-trikloroetana, CH3CCl3.
7. Ulangi langkah 1 hingga 6 dengan menggunakan larutan halida dan halogen seperti ditunjukkan dalam jadual yang berikut.

Keputusan:
Sediakan jadual yang sesuai untuk merekodkan semua pemerhatian dalam bahagian A dan bahagian B.
Perbincangan:
1. Apakah fungsi 1,1,1-trikloroetana, CH3CCl3 dalam eksperimen ini?
2. Nyatakan halogen yang dapat;
(a) menyesarkan klorin, Cl2 daripada larutan kalium klorida, KCl,
(b) menyesarkan bromin, Br2 daripada larutan kalium bromida, KBr, dan
(c) menyesarkan iodin, I2 daripada larutan kalium iodida, KI.
3. Bagi setiap tindak balas penyesaran halogen yang berlaku;
(a) tuliskan setengah persamaan pengoksidaan dan setengah persamaan penurunan,
(b) tuliskan persamaan ion keseluruhan bagi tindak balas redoks itu, dan
(c) kenal pasti bahan yang dioksidakan, bahan yang diturunkan, agen pengoksidaan dan agen penurunan. Berikan sebab bagi jawapan anda.
4. Berdasarkan pemerhatian daripada aktiviti makmal ini;
(a) susun klorin, Cl2, bromin, Br2 dan iodin, I2 dari segi kekuatan sebagai agen pengoksidaandalam tertib menaik,
(b) deduksikan hubungan antara kekuatan sesuatu halogen sebagai agen pengoksidaan dengan kedudukan halogen dalam Kumpulan 17, dan
(c) susun ion klorida, Cl−, ion bromida, Br− dan ion iodida, I− berdasarkan kekuatan sebagai agen penurunan dalam tertib menaik.
Jawapan:
Keputusan:
Jadual untuk merekod pemerhatian.

1. Menentusahkan kehadiran suatu halogen.
2.
(a) Tiada
(b) Air klorin.
(c) Air klorin dan air bromin.
3.
KBr dan Cl2
(a)
Setengah persamaan pengoksidaan : 2Br− → Br2 + 2e−
Setengah persamaan penurunan: Cl2 + 2e− → 2Cl−
(b) Persamaan ion keseluruhan: 2Br− + Cl2 → Br2 + 2Cl−
(c)
– Ion Br− dioksidakan kerana ion Br− membebaskan elektron menghasilkan molekul bromin, Br2 manakala klorin diturunkan kerana molekul klorin, Cl2 menerima elektron menghasilkan ion klorida, Cl−
– Air klorin adalah agen pengoksidaan kerana klorin merupakan penerima elektron manakala kalium bromida adalah agen penurunan kerana ion Br− merupakan penderma elektron.
KI dan Cl2
(a)
Setengah persamaan pengoksidaan : 2I− → I2 + 2e−
Setengah persamaan penurunan: Cl2 + 2e− → 2Cl−
(b) Persamaan ion keseluruhan: 2I− + Cl2 → I2 + 2Cl−
(c)
– Ion I− dioksidakan kerana ion I− membebaskan elektron menghasilkan molekul iodin, I2 manakala klorin diturunkan kerana molekul klorin, Cl2 menerima elektron menghasilkan ion klorida, Cl−
– Air klorin adalah agen pengoksidaan kerana klorin merupakan penerima elektron manakala kalium iodida adalah agen penurunan kerana ion I− merupakan penderma elektron.
KI dan Br2
(a)
Setengah persamaan pengoksidaan : 2I− → I2 + 2e−
Setengah persamaan penurunan: Br2 + 2e− → 2Br−
(b) Persamaan ion keseluruhan: 2I− + Br2 → I2 + 2Br−
(c)
– Ion I− dioksidakan kerana ion iodida, I− membebaskan elektron menghasilkan molekul iodin, I2 manakala bromin diturunkan kerana molekul bromin, Br2 menerima elektron menghasilkan ion bromida, Br−.
– Air bromin adalah agen pengoksidaan kerana bromin merupakan penerima elektron manakala kalium iodida adalah agen penurunan kerana ion I− merupakan penderma elektron.
4.
(a) I2, Br2, Cl2
(b) Kekuatan halogen sebagai agen pengoksidaan semakin berkurang apabila menuruni Kumpulan 17.
(c) Cl−, Br−, I−
