Aktiviti Makmal 1E (Elektrolisis Leburan Plumbum(II) bromida, PbBr2):
Tujuan : Mengkaji elektrolisis leburan plumbum(II) bromida, PbBr2.
Bahan : Serbuk plumbum(II) bromida, PbBr2.
Radas : Bikar, mangkuk pijar, mentol, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, tungku kaki tiga, alas segi tiga tanah liat dan penunu Bunsen.
Prosedur:
1. Isi mangkuk pijar dengan serbuk plumbum(II) bromida, PbBr2 sehingga setengah penuh.
2. Letakkan mangkuk pijar itu di atas alas segi tiga tanah liat pada tungku kaki tiga.
3. Sambungkan elektrod karbon pada bateri, mentol dan suis dengan menggunakan wayar penyambung seperti ditunjukkan pada Rajah 1.24.
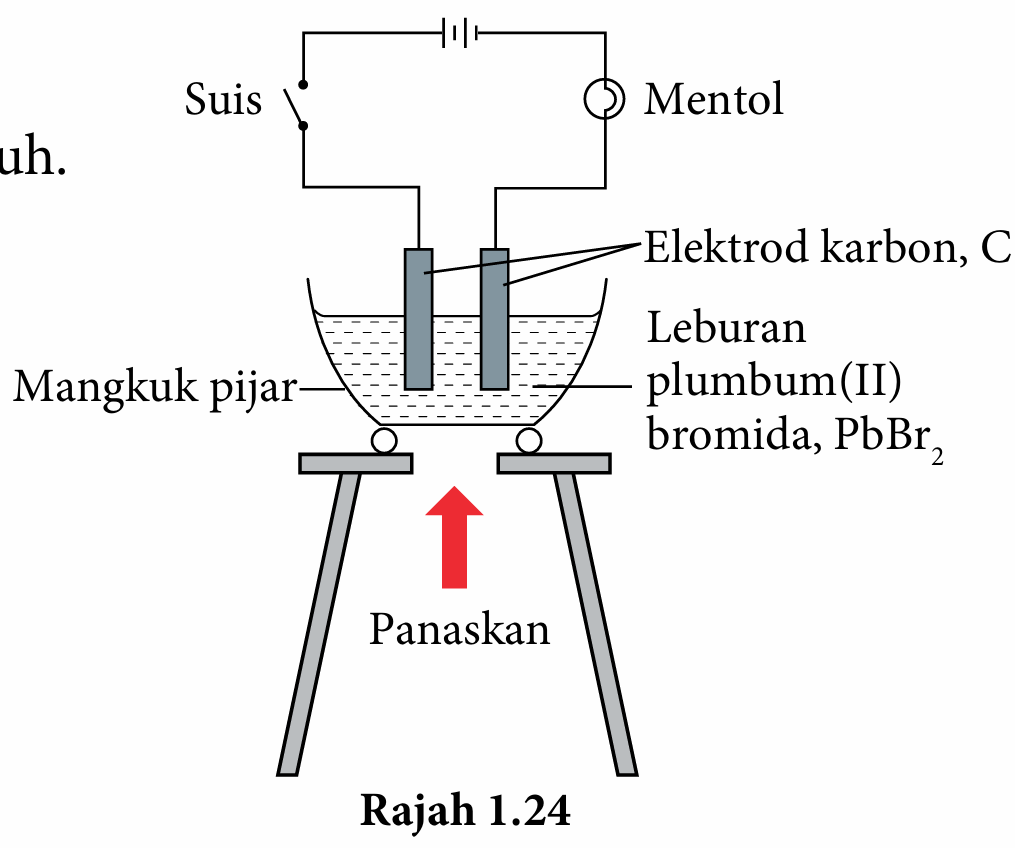
4. Panaskan serbuk plumbum(II) bromida, PbBr2 sehingga lebur.
5. Celupkan elektrod karbon, C ke dalam leburan plumbum(II) bromida, PbBr2 dan hidupkan suis untuk melengkapkan litar.
6. Perhatikan dan rekodkan perubahan yang berlaku pada anod.
7. Selepas 5 minit, matikan suis dan dengan cermat tuangkan leburan plumbum(II) bromida, PbBr2 ke dalam sebuah bikar.
8. Perhatikan bahan yang terbentuk pada anod dan katod serta rekodkan pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
1. Namakan ion yang bergerak ke katod dan anod semasa elektrolisis.
2. Tuliskan setengah persamaan yang berlaku di:
(a) Katod.
(b) Anod.
3. Kenal pasti hasil yang terbentuk di katod dan anod.
4. Terangkan bagaimana hasil pada katod dan anod terbentuk.
5. Tuliskan persamaan ion keseluruhan yang mewakili elektrolisis leburan plumbum(II) bromida, PbBr2.
Jawapan:
1. Ion plumbum(II) bergerak ke katod dan ion bromida bergerak ke anod.
2.
(a) Pb2+ + 2e− → Pb
(b) 2Br− → Br2 + 2e−
3.
Katod : Plumbum
Anod : Bromin
4.
Katod : Ion plumbum(II) menerima dua elektron membentuk atom plumbum.
Anod : Ion bromida membebaskan satu elektron membentuk atom bromin. Dua atom bromin bergabung membentuk molekul bromin. (ATAU dua ion bromida membebaskan dua elektron membentuk molekul bromin)
5. Pb2+ + 2Br− → Pb + Br2
Tujuan : Mengkaji elektrolisis leburan plumbum(II) bromida, PbBr2.
Bahan : Serbuk plumbum(II) bromida, PbBr2.
Radas : Bikar, mangkuk pijar, mentol, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, tungku kaki tiga, alas segi tiga tanah liat dan penunu Bunsen.
Prosedur:
1. Isi mangkuk pijar dengan serbuk plumbum(II) bromida, PbBr2 sehingga setengah penuh.
2. Letakkan mangkuk pijar itu di atas alas segi tiga tanah liat pada tungku kaki tiga.
3. Sambungkan elektrod karbon pada bateri, mentol dan suis dengan menggunakan wayar penyambung seperti ditunjukkan pada Rajah 1.24.

4. Panaskan serbuk plumbum(II) bromida, PbBr2 sehingga lebur.
5. Celupkan elektrod karbon, C ke dalam leburan plumbum(II) bromida, PbBr2 dan hidupkan suis untuk melengkapkan litar.
6. Perhatikan dan rekodkan perubahan yang berlaku pada anod.
7. Selepas 5 minit, matikan suis dan dengan cermat tuangkan leburan plumbum(II) bromida, PbBr2 ke dalam sebuah bikar.
8. Perhatikan bahan yang terbentuk pada anod dan katod serta rekodkan pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
1. Namakan ion yang bergerak ke katod dan anod semasa elektrolisis.
2. Tuliskan setengah persamaan yang berlaku di:
(a) Katod.
(b) Anod.
3. Kenal pasti hasil yang terbentuk di katod dan anod.
4. Terangkan bagaimana hasil pada katod dan anod terbentuk.
5. Tuliskan persamaan ion keseluruhan yang mewakili elektrolisis leburan plumbum(II) bromida, PbBr2.
Jawapan:
1. Ion plumbum(II) bergerak ke katod dan ion bromida bergerak ke anod.
2.
(a) Pb2+ + 2e− → Pb
(b) 2Br− → Br2 + 2e−
3.
Katod : Plumbum
Anod : Bromin
4.
Katod : Ion plumbum(II) menerima dua elektron membentuk atom plumbum.
Anod : Ion bromida membebaskan satu elektron membentuk atom bromin. Dua atom bromin bergabung membentuk molekul bromin. (ATAU dua ion bromida membebaskan dua elektron membentuk molekul bromin)
5. Pb2+ + 2Br− → Pb + Br2
