Eksperimen 1A (Menentukan Nilai Voltan dalam Sel Kimia) :
Tujuan: Menentukan nilai voltan dalam sel kimia dengan menggunakan pasangan logam yang berlainan.
Penyataan masalah: Bagaimanakah pasangan logam yang berlainan dicelup ke dalam elektrolit mempengaruhi nilai voltan sel kimia?
Hipotesis: Semakin besar perbezaan nilai keupayaan elektrod piawai pasangan logam, semakin besar nilai voltan sel.
Pemboleh ubah:
(a) Pemboleh ubah dimanipulasikan : Pasangan logam berlainan.
(b) Pemboleh ubah bergerak balas : Nilai voltan sel.
(c) Pemboleh ubah dimalarkan : Isi padu dan kepekatan elektrolit.
Definisi secara operasi – Sel Kimia: Voltmeter menunjukkan bacaan apabila pasangan logam yang berlainan jenis dicelup ke dalam elektrolit.
Bahan: Nyatakan senarai kepingan logam yang berlainan dan larutan garam ion logam yang sesuai dengan kepekatan 1.0 mol dm−3.
Radas: Kertas pasir, voltmeter, wayar penyambung dengan klip buaya dan nyatakan radas yang sesuai untuk membina sel kimia.
Prosedur:
1. Dengan menggunakan kepingan logam dan larutan garam yang dibekalkan, rancangkan eksperimen untuk membina sel kimia ringkas atau sel kimia yang menggabungkan dua sel setengah.
2. Lukis susunan radas berlabel sel kimia ringkas atau sel kimia yang menggabungkan dua sel setengah untuk menjalankan ekperimen ini.
3. Tuliskan langkah-langkah penyiasatan dengan jelas.
4. Rekodkan semua pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.
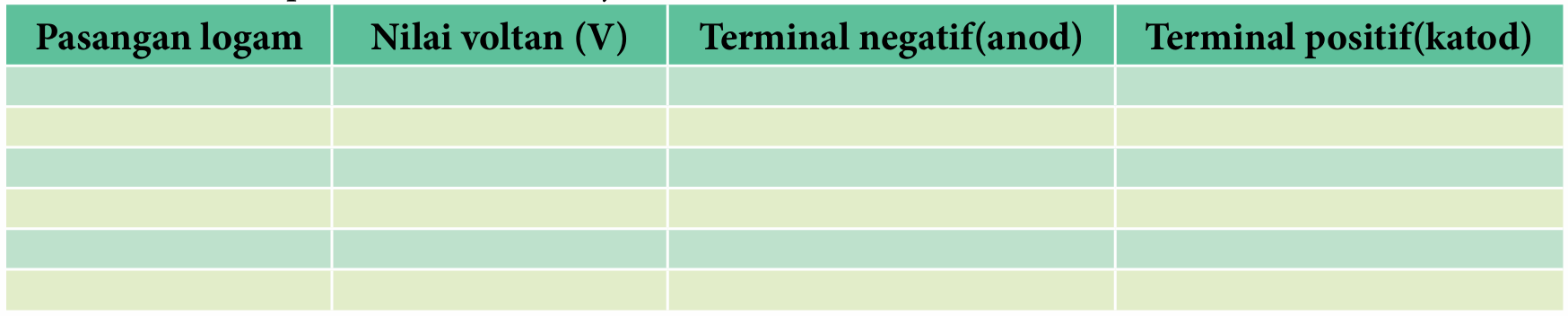
Perbincangan:
Bagi setiap set eksperimen:
1. Tuliskan setengah persamaan pengoksidaan, setengah persamaan penurunan dan persamaan ion keseluruhan.
2. Tuliskan notasi sel bagi sel kimia itu.
3. Hitung voltan sel secara teori dengan menggunakan nilai keupayaan elektrod piawai sel setengah.
4. Deduksikan hubungan antara pasangan logam dengan nilai voltan sel.
Jawapan:
Sampel Jawapan: Sel kimia ringkas
Bahan: Pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan kuprum dan kuprum(II) nitrat.
Radas: Bikar
Prosedur:
1. Gosok pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan stanum dan kepingan kuprum dengan menggunakan kertas pasir.
2. Tuangkan larutan kuprum(II) nitrat 1.0 mol dm−3 ke dalam sebuah bikar sehingga separuh penuh.

3. Sambungkan pita magnesium dan kepingan kuprum ke voltmeter dengan menggunakan wayar penyambung.
4. Celupkan pita magnesium dan kepingan kuprum ke dalam larutan kuprum(II) nitrat bagi melengkapkan litar.
5. Rekodkan bacaan voltmeter, logam di terminal negatif dan logam di terminal positif.
6. Ulangi langkah 3 hingga 5 dengan menggunakan paku besi, kepingan zink dan kepingan plumbum bagi menggantikan pita magnesium.
ATAU
Sampel Jawapan: Sel kimia yang menggabungkan dua sel setengah.
Bahan: Pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan kuprum, larutan magnesium nitrat, larutan ferum(II) nitrat, larutan zink nitrat, larutan plumbum(II) nitrat dan kuprum(II) nitrat.
Radas: Bikar dan pasu berliang
Prosedur:
1. Gosok pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan stanum dan kepingan kuprum dengan menggunakan kertas pasir.
2. Tuangkan larutan magnesium nitrat 1.0 mol dm−3 ke dalam sebuah pasu berliang dan larutan kuprum(II) nitrat 1.0 mol dm−3 ke dalam sebuah bikar sehingga separuh penuh.
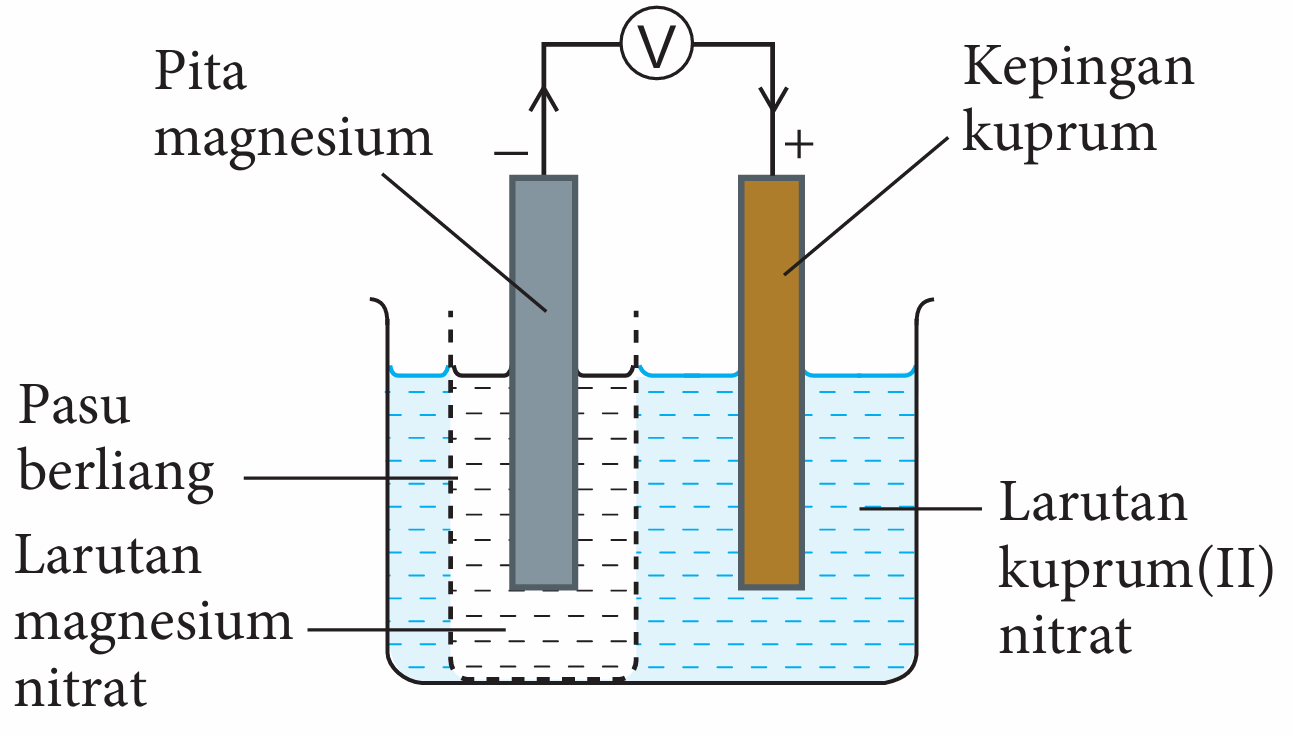
3. Masukkan pasu berliang ke dalam bikar.
4. Sambungkan pita magnesium dan kepingan kuprum ke voltmeter dengan menggunakan wayar penyambung.
5. Celupkan pita magnesium ke dalam larutan magnesium nitrat dan kepingan kuprum ke dalam larutan kuprum(II) nitrat bagi melengkapkan litar.
6. Rekodkan bacaan voltmeter, logam di terminal negatif dan logam di terminal positif.
7. Ulangi langkah 2 hingga 6 dengan menggunakan larutan ferum(II) nitrat, larutan zink nitrat dan larutan plumbum(II) nitrat bagi menggantikan larutan magnesium nitrat dalam pasu berliang dan menggunakan paku besi, kepingan zink dan kepingan plumbum bagi menggantikan pita magnesium.
Perbincangan:
1.
– Pasangan Mg/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Mg} \rightarrow \mathrm{Mg}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Mg}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Mg}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Fe/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Fe} \rightarrow \mathrm{Fe}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Fe}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Fe}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Zn/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Zn} \rightarrow \mathrm{Zn}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Zn}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Zn}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Pb/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Pb} \rightarrow \mathrm{~Pb}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Pb}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Pb}^{2+}+\mathrm{Cu} \end{array} $$
2.
– Pasangan Mg/Cu
$$ \mathrm{Mg}(\mathrm{p})\left|\mathrm{Mg}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Fe/Cu
$$ \mathrm{Fe}(\mathrm{p})\left|\mathrm{Fe}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Zn/Cu
$$ \mathrm{Zn}(\mathrm{p})\left|\mathrm{Zn}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Pb/Cu
$$ \mathrm{Pb}(\mathrm{p})\left|\mathrm{Pb}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}{ }^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
3.
– Pasangan Mg/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-2.38)=+2.72 \mathrm{~V} $$
– Pasangan Fe/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-0.44)=+0.78 \mathrm{~V} $$
– Pasangan Zn/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-0.76)=+1.10 \mathrm{~V} $$
– Pasangan Pb/Cu
$$ \mathrm{E}_{\mathrm{sel}}^0=(+0.34)-(-0.13)=+0.47 \mathrm{~V} $$
4. Semakin besar perbezaan nilai E0 pasangan logam.
Tujuan: Menentukan nilai voltan dalam sel kimia dengan menggunakan pasangan logam yang berlainan.
Penyataan masalah: Bagaimanakah pasangan logam yang berlainan dicelup ke dalam elektrolit mempengaruhi nilai voltan sel kimia?
Hipotesis: Semakin besar perbezaan nilai keupayaan elektrod piawai pasangan logam, semakin besar nilai voltan sel.
Pemboleh ubah:
(a) Pemboleh ubah dimanipulasikan : Pasangan logam berlainan.
(b) Pemboleh ubah bergerak balas : Nilai voltan sel.
(c) Pemboleh ubah dimalarkan : Isi padu dan kepekatan elektrolit.
Definisi secara operasi – Sel Kimia: Voltmeter menunjukkan bacaan apabila pasangan logam yang berlainan jenis dicelup ke dalam elektrolit.
Bahan: Nyatakan senarai kepingan logam yang berlainan dan larutan garam ion logam yang sesuai dengan kepekatan 1.0 mol dm−3.
Radas: Kertas pasir, voltmeter, wayar penyambung dengan klip buaya dan nyatakan radas yang sesuai untuk membina sel kimia.
Prosedur:
1. Dengan menggunakan kepingan logam dan larutan garam yang dibekalkan, rancangkan eksperimen untuk membina sel kimia ringkas atau sel kimia yang menggabungkan dua sel setengah.
2. Lukis susunan radas berlabel sel kimia ringkas atau sel kimia yang menggabungkan dua sel setengah untuk menjalankan ekperimen ini.
3. Tuliskan langkah-langkah penyiasatan dengan jelas.
4. Rekodkan semua pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
Bagi setiap set eksperimen:
1. Tuliskan setengah persamaan pengoksidaan, setengah persamaan penurunan dan persamaan ion keseluruhan.
2. Tuliskan notasi sel bagi sel kimia itu.
3. Hitung voltan sel secara teori dengan menggunakan nilai keupayaan elektrod piawai sel setengah.
4. Deduksikan hubungan antara pasangan logam dengan nilai voltan sel.
Jawapan:
Sampel Jawapan: Sel kimia ringkas
Bahan: Pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan kuprum dan kuprum(II) nitrat.
Radas: Bikar
Prosedur:
1. Gosok pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan stanum dan kepingan kuprum dengan menggunakan kertas pasir.
2. Tuangkan larutan kuprum(II) nitrat 1.0 mol dm−3 ke dalam sebuah bikar sehingga separuh penuh.

3. Sambungkan pita magnesium dan kepingan kuprum ke voltmeter dengan menggunakan wayar penyambung.
4. Celupkan pita magnesium dan kepingan kuprum ke dalam larutan kuprum(II) nitrat bagi melengkapkan litar.
5. Rekodkan bacaan voltmeter, logam di terminal negatif dan logam di terminal positif.
6. Ulangi langkah 3 hingga 5 dengan menggunakan paku besi, kepingan zink dan kepingan plumbum bagi menggantikan pita magnesium.
ATAU
Sampel Jawapan: Sel kimia yang menggabungkan dua sel setengah.
Bahan: Pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan kuprum, larutan magnesium nitrat, larutan ferum(II) nitrat, larutan zink nitrat, larutan plumbum(II) nitrat dan kuprum(II) nitrat.
Radas: Bikar dan pasu berliang
Prosedur:
1. Gosok pita magnesium, paku besi, kepingan zink, kepingan plumbum, kepingan stanum dan kepingan kuprum dengan menggunakan kertas pasir.
2. Tuangkan larutan magnesium nitrat 1.0 mol dm−3 ke dalam sebuah pasu berliang dan larutan kuprum(II) nitrat 1.0 mol dm−3 ke dalam sebuah bikar sehingga separuh penuh.

3. Masukkan pasu berliang ke dalam bikar.
4. Sambungkan pita magnesium dan kepingan kuprum ke voltmeter dengan menggunakan wayar penyambung.
5. Celupkan pita magnesium ke dalam larutan magnesium nitrat dan kepingan kuprum ke dalam larutan kuprum(II) nitrat bagi melengkapkan litar.
6. Rekodkan bacaan voltmeter, logam di terminal negatif dan logam di terminal positif.
7. Ulangi langkah 2 hingga 6 dengan menggunakan larutan ferum(II) nitrat, larutan zink nitrat dan larutan plumbum(II) nitrat bagi menggantikan larutan magnesium nitrat dalam pasu berliang dan menggunakan paku besi, kepingan zink dan kepingan plumbum bagi menggantikan pita magnesium.
Perbincangan:
1.
– Pasangan Mg/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Mg} \rightarrow \mathrm{Mg}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Mg}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Mg}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Fe/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Fe} \rightarrow \mathrm{Fe}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Fe}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Fe}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Zn/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Zn} \rightarrow \mathrm{Zn}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Zn}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Zn}^{2+}+\mathrm{Cu} \end{array} $$
– Pasangan Pb/Cu
$$ \begin{array}{ll} \text { Setengah persamaan pengoksidaan } & : \mathrm{Pb} \rightarrow \mathrm{~Pb}^{2+}+2 \mathrm{e}^{-} \\ \text {Setengah persamaan penurunan } & : \mathrm{Cu}^{2+}+2 \mathrm{e}^{-} \rightarrow \mathrm{Cu} \\ \text { Persamaan ion keseluruhan } & : \mathrm{Pb}+\mathrm{Cu}^{2+} \rightarrow \mathrm{Pb}^{2+}+\mathrm{Cu} \end{array} $$
2.
– Pasangan Mg/Cu
$$ \mathrm{Mg}(\mathrm{p})\left|\mathrm{Mg}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Fe/Cu
$$ \mathrm{Fe}(\mathrm{p})\left|\mathrm{Fe}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Zn/Cu
$$ \mathrm{Zn}(\mathrm{p})\left|\mathrm{Zn}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
– Pasangan Pb/Cu
$$ \mathrm{Pb}(\mathrm{p})\left|\mathrm{Pb}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}^{-3}\right) \| \mathrm{Cu}^{2+}\left(\mathrm{ak}, 1 \mathrm{~mol} \mathrm{dm}{ }^{-3}\right)\right| \mathrm{Cu}(\mathrm{p}) $$
3.
– Pasangan Mg/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-2.38)=+2.72 \mathrm{~V} $$
– Pasangan Fe/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-0.44)=+0.78 \mathrm{~V} $$
– Pasangan Zn/Cu
$$ \mathrm{E}_{\text {sel }}^0=(+0.34)-(-0.76)=+1.10 \mathrm{~V} $$
– Pasangan Pb/Cu
$$ \mathrm{E}_{\mathrm{sel}}^0=(+0.34)-(-0.13)=+0.47 \mathrm{~V} $$
4. Semakin besar perbezaan nilai E0 pasangan logam.
