Eksperimen 1B (Kesan Kepekatan Ion dalam Larutan Terhadap Pemilihan Ion untuk Dinyahcas) :
Tujuan: Mengkaji kesan kepekatan ion di dalam asid hidroklorik, HCl terhadap pemilihan ion untuk dinyahcas pada elektrod.
Penyataan masalah: Adakah kepekatan asid hidroklorik, HCl mempengaruhi pemilihan ion untuk dinyahcas pada anod?
Hipotesis: Apabila asid hidroklorik, HCl 1.0 mol dm−3 digunakan, ion klorida, Cl− dinyahcas pada anod, manakala apabila asid hidroklorik, HCl 0.0001 mol dm−3 digunakan, ion hidroksida, OH− dinyahcas pada anod.
Pemboleh ubah:
(a) Pemboleh ubah dimanipulasikan : Kepekatan asid hidroklorik, HCl.
(b) Pemboleh ubah bergerak balas : Ion yang dinyahcas pada anod.
(c) Pemboleh ubah dimalarkan : Asid hidroklorik, HCl, elektrod karbon.
Bahan: Asid hidroklorik, HCl 1.0 mol dm−3 dan asid hidroklorik, HCl 0.0001 mol dm−3.
Radas: Sel elektrolisis, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, ammeter, tabung uji, kayu uji dan kertas litmus biru.
Prosedur:
1. Tuangkan larutan asid hidroklorik, HCl 1.0 mol dm−3 ke dalam sel elektrolisis sehingga setengah penuh.
2. Isikan dua tabung uji dengan asid hidroklorik, HCl 1.0 mol dm−3 sehingga penuh dan telangkupkan tabung uji itu ke atas elektrod karbon di dalam sel elektrolisis.
3. Sambungkan elektrod karbon kepada suis, ammeter dan bateri dengan wayar penyambung seperti pada Rajah 1.30.
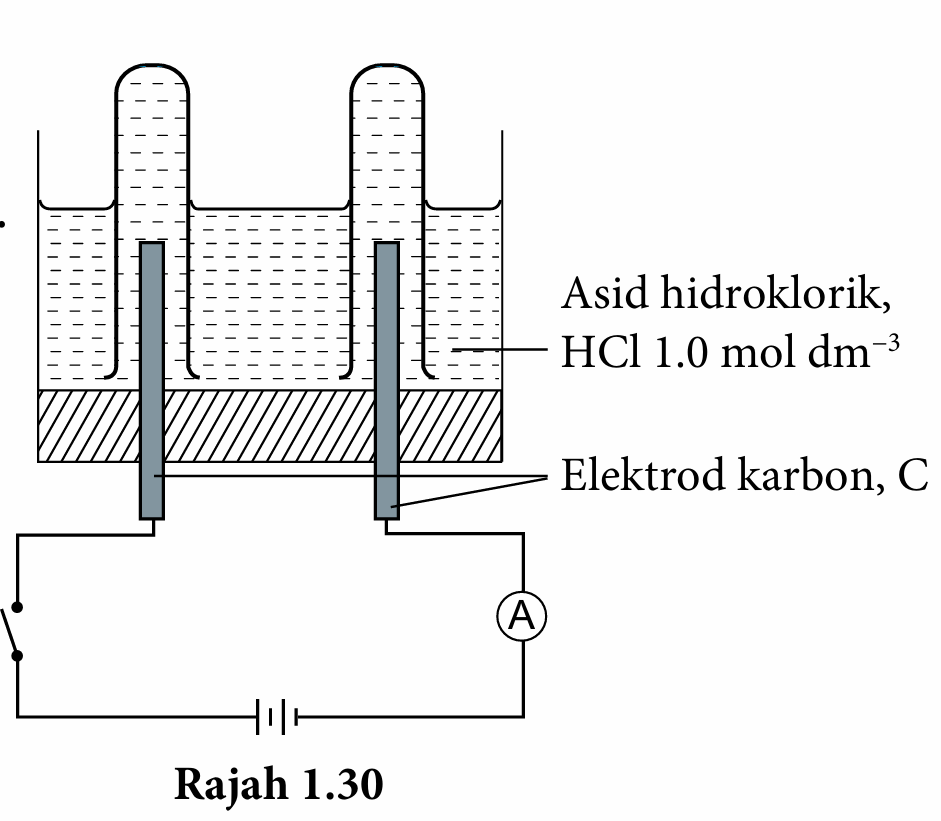
4. Hidupkan suis untuk melengkapkan litar dan biarkan selama beberapa minit.
5. Perhatikan dan rekodkan perubahan yang berlaku pada anod dan katod.
6. Kumpulkan gas yang terhasil pada anod.
7. Lakukan ujian pengesahan pada gas yang dikumpulkan. Masukkan kertas litmus biru lembap ke dalam tabung uji pada anod.
8. Ulangi langkah 1 hingga 6 dengan menggunakan asid hidroklorik, HCl 0.0001 mol dm−3.
9. Lakukan ujian pengesahan pada gas yang dikumpulkan. Masukkan kayu uji berbara ke dalam tabung uji pada anod.
10. Rekodkan pemerhatian anda.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
1. Bagi setiap asid hidroklorik, HCl 1.0 mol dm−3 dan 0.0001 mol dm−3:
(a) Namakan hasil yang terbentuk pada anod semasa elektrolisis. Terangkan jawapan anda.
(b) Tulis setengah persamaan untuk menunjukkan pembentukan hasil pada anod bagi elektrolisis.
2. Nyatakan definisi secara operasi bagi elektrolisis dalam eksperimen ini.
3. Setelah elektrolisis asid hidroklorik, HCl 1.0 mol dm−3 dijalankan selama 1 jam, nyatakan pemerhatian pada anod. Terangkan.
Jawapan:
1.
Asid hidroklorik, HCl 1.0 mol dm−3
(a) Klorin.
Ion klorida dinyahcas kerana kepekatan ion Cl− lebih tinggi berbanding ion OH−.
Dua ion klorida membebaskan dua elektron membentuk molekul klorin.
(b) 2Cl− → Cl2 + 2e−
Asid hidroklorik, HCl 0.0001 mol dm−3
(a) Oksigen
Ion hidroksida dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−
Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air
(b) 4OH− → O2 + 2H2O + 4e−
2. Proses penguraian elektrolit yang menghasilkan gelembung-gelembung gas pada anod apabila elektrod karbon yang disambungkan kepada bateri dicelup ke dalam asid hidroklorik
3. Gelembung gas tak berwarna dibebaskan. Ion hidroksida dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−. Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air.
Tujuan: Mengkaji kesan kepekatan ion di dalam asid hidroklorik, HCl terhadap pemilihan ion untuk dinyahcas pada elektrod.
Penyataan masalah: Adakah kepekatan asid hidroklorik, HCl mempengaruhi pemilihan ion untuk dinyahcas pada anod?
Hipotesis: Apabila asid hidroklorik, HCl 1.0 mol dm−3 digunakan, ion klorida, Cl− dinyahcas pada anod, manakala apabila asid hidroklorik, HCl 0.0001 mol dm−3 digunakan, ion hidroksida, OH− dinyahcas pada anod.
Pemboleh ubah:
(a) Pemboleh ubah dimanipulasikan : Kepekatan asid hidroklorik, HCl.
(b) Pemboleh ubah bergerak balas : Ion yang dinyahcas pada anod.
(c) Pemboleh ubah dimalarkan : Asid hidroklorik, HCl, elektrod karbon.
Bahan: Asid hidroklorik, HCl 1.0 mol dm−3 dan asid hidroklorik, HCl 0.0001 mol dm−3.
Radas: Sel elektrolisis, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, ammeter, tabung uji, kayu uji dan kertas litmus biru.
Prosedur:
1. Tuangkan larutan asid hidroklorik, HCl 1.0 mol dm−3 ke dalam sel elektrolisis sehingga setengah penuh.
2. Isikan dua tabung uji dengan asid hidroklorik, HCl 1.0 mol dm−3 sehingga penuh dan telangkupkan tabung uji itu ke atas elektrod karbon di dalam sel elektrolisis.
3. Sambungkan elektrod karbon kepada suis, ammeter dan bateri dengan wayar penyambung seperti pada Rajah 1.30.

4. Hidupkan suis untuk melengkapkan litar dan biarkan selama beberapa minit.
5. Perhatikan dan rekodkan perubahan yang berlaku pada anod dan katod.
6. Kumpulkan gas yang terhasil pada anod.
7. Lakukan ujian pengesahan pada gas yang dikumpulkan. Masukkan kertas litmus biru lembap ke dalam tabung uji pada anod.
8. Ulangi langkah 1 hingga 6 dengan menggunakan asid hidroklorik, HCl 0.0001 mol dm−3.
9. Lakukan ujian pengesahan pada gas yang dikumpulkan. Masukkan kayu uji berbara ke dalam tabung uji pada anod.
10. Rekodkan pemerhatian anda.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
1. Bagi setiap asid hidroklorik, HCl 1.0 mol dm−3 dan 0.0001 mol dm−3:
(a) Namakan hasil yang terbentuk pada anod semasa elektrolisis. Terangkan jawapan anda.
(b) Tulis setengah persamaan untuk menunjukkan pembentukan hasil pada anod bagi elektrolisis.
2. Nyatakan definisi secara operasi bagi elektrolisis dalam eksperimen ini.
3. Setelah elektrolisis asid hidroklorik, HCl 1.0 mol dm−3 dijalankan selama 1 jam, nyatakan pemerhatian pada anod. Terangkan.
Jawapan:
1.
Asid hidroklorik, HCl 1.0 mol dm−3
(a) Klorin.
Ion klorida dinyahcas kerana kepekatan ion Cl− lebih tinggi berbanding ion OH−.
Dua ion klorida membebaskan dua elektron membentuk molekul klorin.
(b) 2Cl− → Cl2 + 2e−
Asid hidroklorik, HCl 0.0001 mol dm−3
(a) Oksigen
Ion hidroksida dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−
Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air
(b) 4OH− → O2 + 2H2O + 4e−
2. Proses penguraian elektrolit yang menghasilkan gelembung-gelembung gas pada anod apabila elektrod karbon yang disambungkan kepada bateri dicelup ke dalam asid hidroklorik
3. Gelembung gas tak berwarna dibebaskan. Ion hidroksida dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−. Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air.
