Aktiviti Makmal 1H (Penulenan Logam Secara Elektrolisis) :
Tujuan : Mengkaji penulenan kuprum secara elektrolisis.
Bahan : Larutan kuprum(II) nitrat, Cu(NO3)2 1.0 mol dm−3, kepingan kuprum tidak tulen dan kepingan kuprum tulen.
Radas : Bikar, bateri, wayar penyambung dengan klip buaya, ammeter dan suis.
Prosedur:
1. Tuangkan larutan kuprum(II) nitrat, Cu(NO3)2 1.0 mol dm−3 ke dalam bikar sehingga separuh penuh.
2. Sambungkan kepingan kuprum tulen ke terminal negatif bateri dan kepingan kuprum tidak tulen ke terminal positif bateri seperti pada Rajah 1.34.
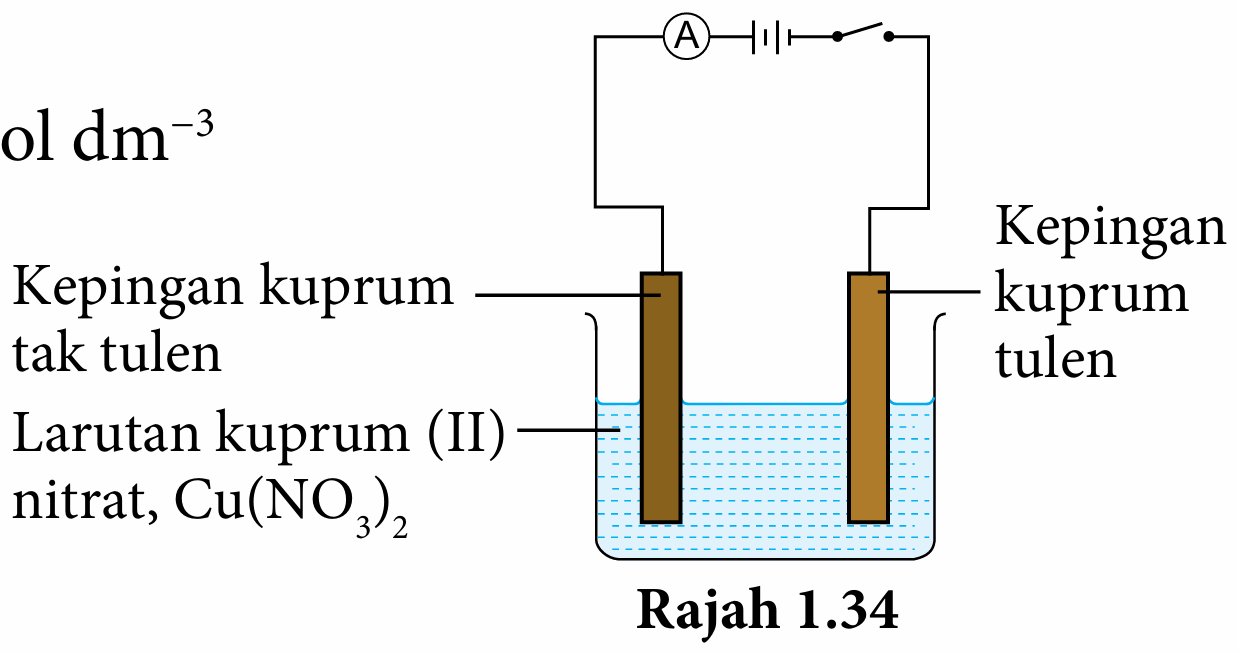
3. Hidupkan suis dan biarkan arus elektrik mengalir selama 30 minit.
4. Rekodkan perubahan pada anod dan katod dalam jadual di bawah.
Keputusan:

Perbincangan:
1. Adakah proses penulenan logam kuprum merupakan suatu tindak balas redoks? Terangkan jawapan anda.
2. Adakah berlaku perubahan warna pada larutan kuprum(II) nitrat, Cu(NO3)2?
Terangkan jawapan anda.
3. Bendasing hanya terbentuk pada bahagian bawah anod dan tiada di bawah katod.
Berikan satu sebab.
4. Tuliskan kesimpulan eksperimen ini
Jawapan:
1. Ya. Tindak balas pengoksidaan berlaku di kepingan kuprum tak tulen (anod) apabila atom kuprum mendermakan elektron membentuk ion Cu2+ dan tindak balas penurunan berlaku di kepingan kuprum tulen (katod) apabila ion Cu2+ menerima elektron membentuk atom kuprum.
2. Warna biru larutan kuprum(II) nitrat tidak berubah kerana kepekatan ion Cu2+ tidak berubah.
Kadar ion Cu2+ dinyahcas di katod adalah sama dengan kadar atom kuprum mengion di anod.
3. Anod merupakan kepingan kuprum tak tulen yang mengandungi bendasing. Semasa kuprum tak tulen mengion dan larut, bendasing dimendakkan di bawah anod. Katod merupakan kuprum tulen yang tidak mengandungi bendasing.
4. Penulenan logam kuprum boleh dilakukan melalui proses elektrolisis.
Tujuan : Mengkaji penulenan kuprum secara elektrolisis.
Bahan : Larutan kuprum(II) nitrat, Cu(NO3)2 1.0 mol dm−3, kepingan kuprum tidak tulen dan kepingan kuprum tulen.
Radas : Bikar, bateri, wayar penyambung dengan klip buaya, ammeter dan suis.
Prosedur:
1. Tuangkan larutan kuprum(II) nitrat, Cu(NO3)2 1.0 mol dm−3 ke dalam bikar sehingga separuh penuh.
2. Sambungkan kepingan kuprum tulen ke terminal negatif bateri dan kepingan kuprum tidak tulen ke terminal positif bateri seperti pada Rajah 1.34.

3. Hidupkan suis dan biarkan arus elektrik mengalir selama 30 minit.
4. Rekodkan perubahan pada anod dan katod dalam jadual di bawah.
Keputusan:

Perbincangan:
1. Adakah proses penulenan logam kuprum merupakan suatu tindak balas redoks? Terangkan jawapan anda.
2. Adakah berlaku perubahan warna pada larutan kuprum(II) nitrat, Cu(NO3)2?
Terangkan jawapan anda.
3. Bendasing hanya terbentuk pada bahagian bawah anod dan tiada di bawah katod.
Berikan satu sebab.
4. Tuliskan kesimpulan eksperimen ini
Jawapan:
1. Ya. Tindak balas pengoksidaan berlaku di kepingan kuprum tak tulen (anod) apabila atom kuprum mendermakan elektron membentuk ion Cu2+ dan tindak balas penurunan berlaku di kepingan kuprum tulen (katod) apabila ion Cu2+ menerima elektron membentuk atom kuprum.
2. Warna biru larutan kuprum(II) nitrat tidak berubah kerana kepekatan ion Cu2+ tidak berubah.
Kadar ion Cu2+ dinyahcas di katod adalah sama dengan kadar atom kuprum mengion di anod.
3. Anod merupakan kepingan kuprum tak tulen yang mengandungi bendasing. Semasa kuprum tak tulen mengion dan larut, bendasing dimendakkan di bawah anod. Katod merupakan kuprum tulen yang tidak mengandungi bendasing.
4. Penulenan logam kuprum boleh dilakukan melalui proses elektrolisis.
