Soalan 1:
Jadual 1.11 menunjukkan elektrod, elektrolit dan pemerhatian pada anod bagi tiga sel elektrolisis.
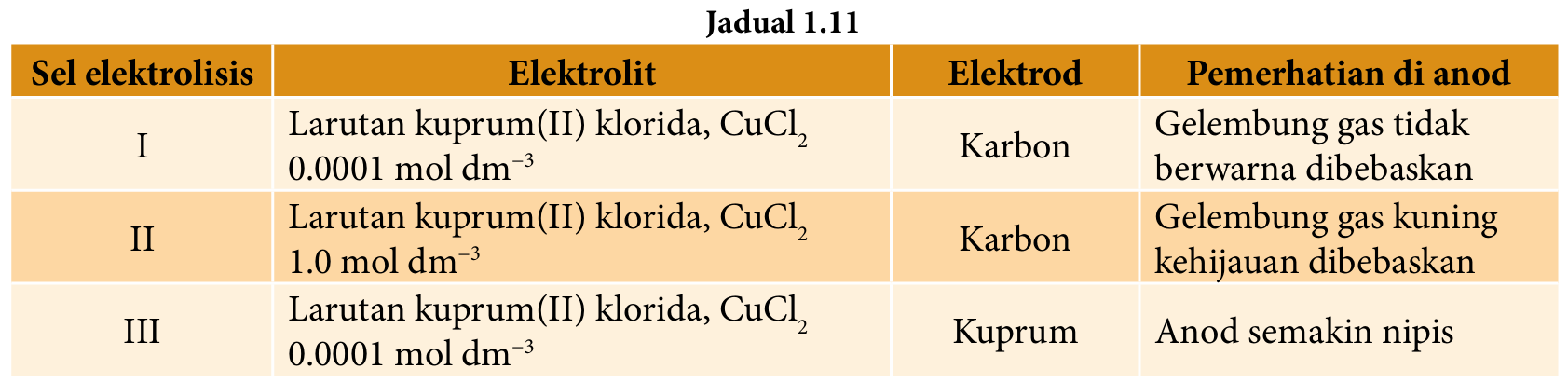
(a) Namakan anion yang terdapat di dalam larutan kuprum(II) klorida, CuCl2.
(b) Nyatakan nama gas yang terhasil pada anod di dalam sel elektrolisis I dan II.
Terangkan jawapan anda.
(c) (i) Tuliskan setengah persamaan bagi tindak balas yang berlaku pada anod sel elektrolisis III.
(ii) Terangkan bagaimana hasil pada anod sel elektrolisis III terbentuk.
(d) Nyatakan jenis tindak balas yang berlaku pada anod.
(e) Sekiranya eksperimen sel elektrolisis I diulangi dengan menggunakan leburan kuprum(II) klorida, CuCl2, ramalkan pemerhatian pada anod.
Jawapan:
(a) Ion klorida dan ion hidroksida.
(b)
Sel elektrolisis I
– Gas oksigen.
– Ion OH− dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−
– Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air
Sel elektrolisis II
– Gas klorin
– Ion Cl− dinyahcas kerana kepekatan ion Cl− lebih tinggi berbanding ion OH−.
– Dua ion klorida membebaskan dua elektron membentuk molekul klorin.
(c)(i) Cu → Cu2+ + 2e−
(c)(ii)
– Kuprum adalah elektrod aktif.
– Atom kuprum mengion membentuk ion Cu2+ di anod.
(d) Tindak balas pengoksidaan.
(e) Gas kuning kehijauan dibebaskan
Jadual 1.11 menunjukkan elektrod, elektrolit dan pemerhatian pada anod bagi tiga sel elektrolisis.

(a) Namakan anion yang terdapat di dalam larutan kuprum(II) klorida, CuCl2.
(b) Nyatakan nama gas yang terhasil pada anod di dalam sel elektrolisis I dan II.
Terangkan jawapan anda.
(c) (i) Tuliskan setengah persamaan bagi tindak balas yang berlaku pada anod sel elektrolisis III.
(ii) Terangkan bagaimana hasil pada anod sel elektrolisis III terbentuk.
(d) Nyatakan jenis tindak balas yang berlaku pada anod.
(e) Sekiranya eksperimen sel elektrolisis I diulangi dengan menggunakan leburan kuprum(II) klorida, CuCl2, ramalkan pemerhatian pada anod.
Jawapan:
(a) Ion klorida dan ion hidroksida.
(b)
Sel elektrolisis I
– Gas oksigen.
– Ion OH− dinyahcas kerana nilai E0 ion OH− kurang positif berbanding nilai E0 ion Cl−
– Empat ion OH− membebaskan empat elektron membentuk molekul oksigen dan air
Sel elektrolisis II
– Gas klorin
– Ion Cl− dinyahcas kerana kepekatan ion Cl− lebih tinggi berbanding ion OH−.
– Dua ion klorida membebaskan dua elektron membentuk molekul klorin.
(c)(i) Cu → Cu2+ + 2e−
(c)(ii)
– Kuprum adalah elektrod aktif.
– Atom kuprum mengion membentuk ion Cu2+ di anod.
(d) Tindak balas pengoksidaan.
(e) Gas kuning kehijauan dibebaskan
Soalan 2:
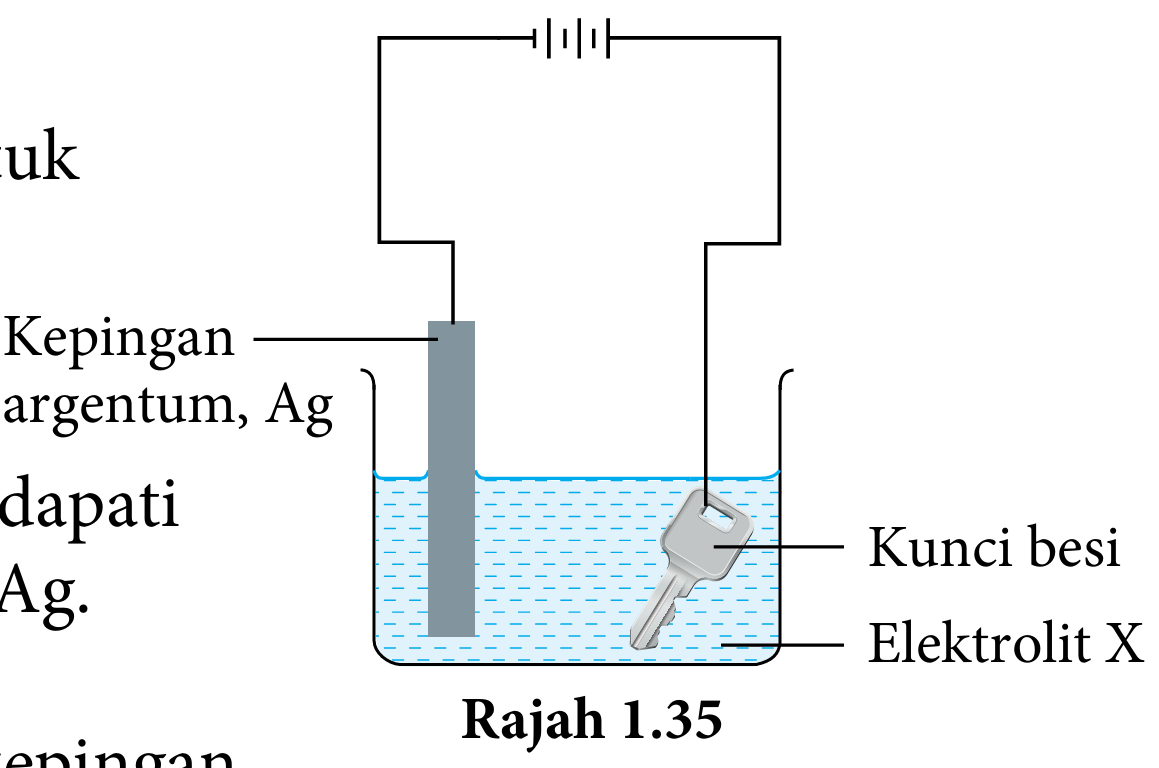
Salim menggunakan susunan radas pada Rajah 1.35 untuk menyadur kunci besi dengan logam argentum, Ag.
(a) Apakah tujuan kunci besi ini disadur dengan argentum, Ag?
(b) Selepas 30 minit eksperimen dijalankan, Salim mendapati kunci besi masih belum disadur dengan argentum, Ag.
(i) Cadangkan elektrolit X yang sesuai digunakan.
(ii) Apakah yang patut dilakukan oleh Salim pada kepingan argentum, Ag dan kunci besi supaya kunci besi tersebut dapat disadur dengan argentum, Ag?
Jawapan:
(a) Menjadikan kunci besi tahan kakisan / lebih menarik.
(b)(i) Larutan argentum nitrat
(b)(ii) Kunci besi disambung ke terminal negatif bateri dan kepingan argentum disambung ke terminal positif bateri.

Salim menggunakan susunan radas pada Rajah 1.35 untuk menyadur kunci besi dengan logam argentum, Ag.
(a) Apakah tujuan kunci besi ini disadur dengan argentum, Ag?
(b) Selepas 30 minit eksperimen dijalankan, Salim mendapati kunci besi masih belum disadur dengan argentum, Ag.
(i) Cadangkan elektrolit X yang sesuai digunakan.
(ii) Apakah yang patut dilakukan oleh Salim pada kepingan argentum, Ag dan kunci besi supaya kunci besi tersebut dapat disadur dengan argentum, Ag?
Jawapan:
(a) Menjadikan kunci besi tahan kakisan / lebih menarik.
(b)(i) Larutan argentum nitrat
(b)(ii) Kunci besi disambung ke terminal negatif bateri dan kepingan argentum disambung ke terminal positif bateri.
Soalan 3:
Anda dikehendaki menjalankan eksperimen menulenkan logam nikel, Ni dengan menggunakan kaedah elektrolisis:
(a) Lukis susunan radas berlabel yang digunakan dalam eksperimen ini.
(b) Nyatakan pemerhatian pada anod dan katod.
(c) Tulis setengah persamaan bagi tindak balas yang berlaku pada anod.
Jawapan:
(a)
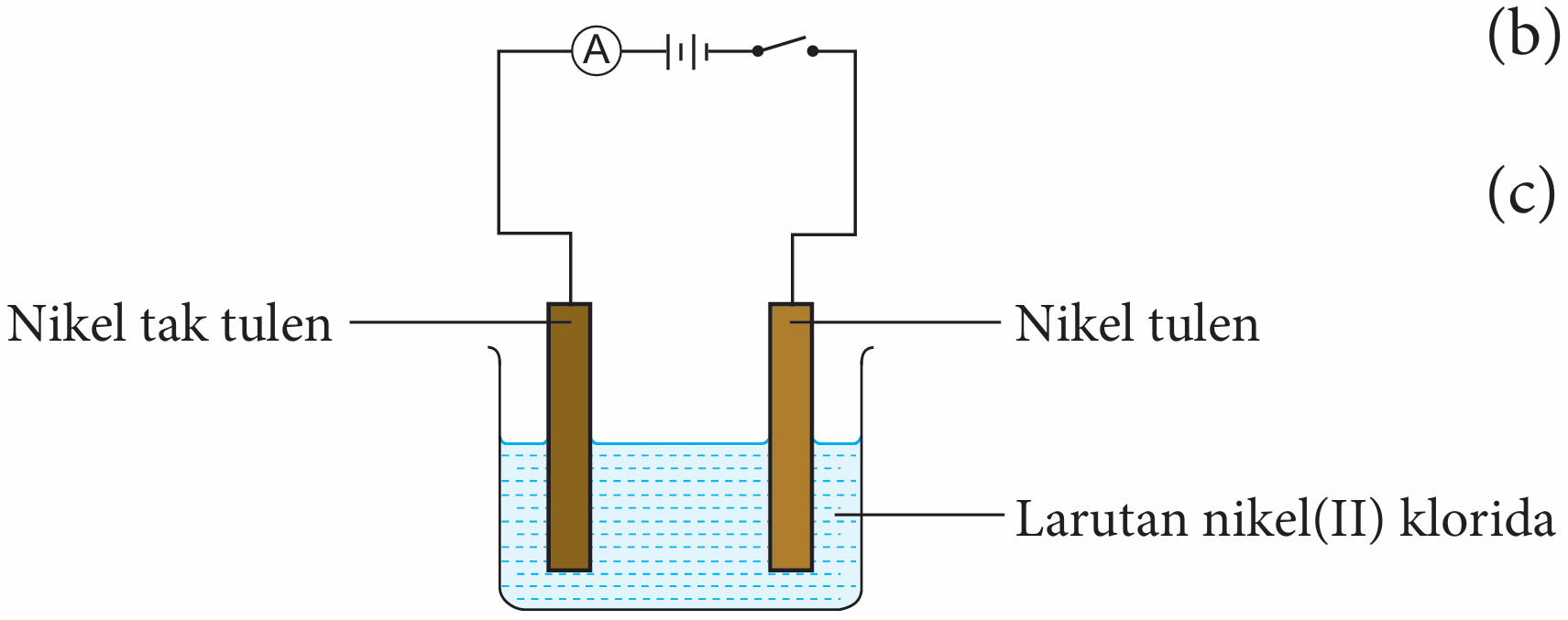
(b) Anod : Logam nikel tak tulen semakin nipis.
Katod: Logam nikel tulen semakin tebal
(c) Ni → Ni2+ + 2e−
Anda dikehendaki menjalankan eksperimen menulenkan logam nikel, Ni dengan menggunakan kaedah elektrolisis:
(a) Lukis susunan radas berlabel yang digunakan dalam eksperimen ini.
(b) Nyatakan pemerhatian pada anod dan katod.
(c) Tulis setengah persamaan bagi tindak balas yang berlaku pada anod.
Jawapan:
(a)

(b) Anod : Logam nikel tak tulen semakin nipis.
Katod: Logam nikel tulen semakin tebal
(c) Ni → Ni2+ + 2e−
