Aktiviti Makmal 1F (Elektrolisis Larutan Akueus dengan Menggunakan Elektrod Karbon) :
Tujuan : Mengkaji elektrolisis larutan akueus kuprum(II) sulfat, CuSO4 dan asid sulfurik, H2SO4 cair dengan menggunakan elektrod karbon.
Bahan : Larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 dan asid sulfurik, H2SO4 0.1 mol dm−3.
Radas : Sel elektrolisis, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, ammeter, tabung uji dan kayu uji.
Prosedur:
1. Tuangkan larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 ke dalam sel elektrolisis sehingga setengah penuh.
2. Isikan dua tabung uji dengan larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 sehingga penuh dan telangkupkan tabung uji itu ke atas elektrod karbon dalam sel elektrolisis.
3. Sambungkan elektrod karbon kepada suis, ammeter dan bateri dengan wayar penyambung untuk melengkapkan litar seperti pada Rajah 1.27.
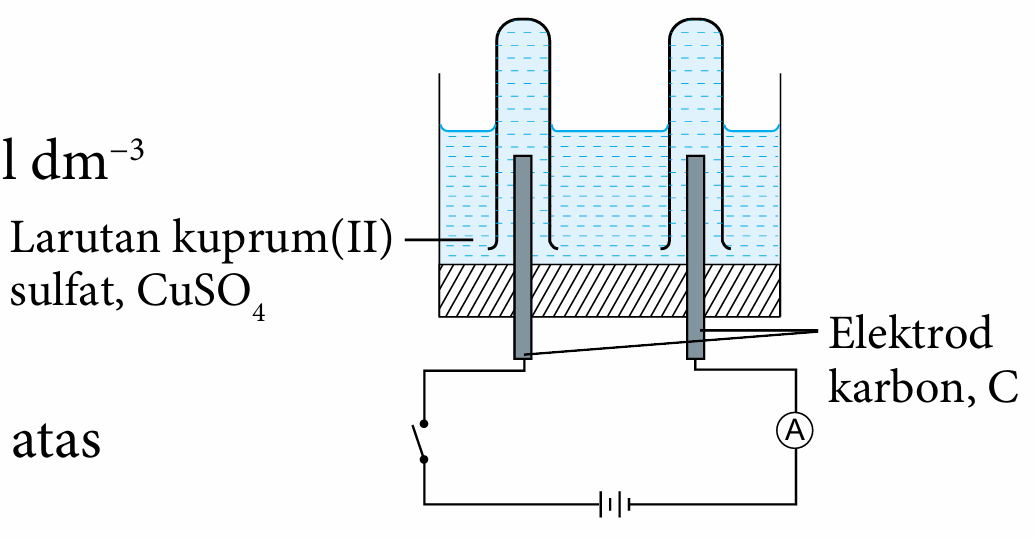
4. Hidupkan suis selama beberapa minit.
5. Perhatikan dan rekodkan perubahan yang berlaku pada anod dan katod.
6. Lakukan ujian pengesahan pada gas yang dikumpulkan:
(a) Masukkan kayu uji berbara ke dalam tabung uji pada anod.
(b) Letak kayu uji bernyala ke dalam tabung uji pada katod.
7. Ulangi langkah 1 hingga 6 dengan menggunakan asid sulfurik, H2SO4 0.1 mol dm−3.
8. Rekodkan pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
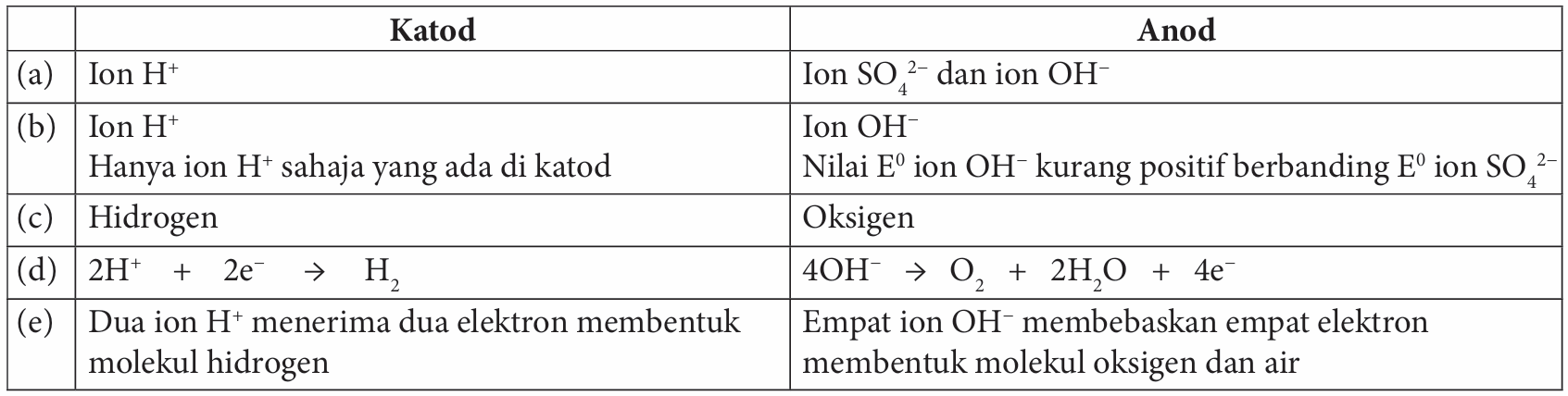
1. Nyatakan ion-ion yang hadir dalam larutan akueus:
(a) Larutan kuprum(II) sulfat, CuSO4.
(b) Asid sulfurik, H2SO4.
2. Bagi larutan kuprum(II) sulfat, CuSO4 dan asid sulfurik, H2SO4 :
(a) Namakan ion yang bergerak ke katod dan anod semasa elektrolisis.
(b) Kenal pasti ion yang dinyahcas pada katod dan anod. Berikan sebab kepada jawapan anda.
(c) Namakan hasil yang terbentuk pada katod dan anod.
(d) Tuliskan setengah persamaan yang berlaku pada katod dan anod.
(e) Terangkan bagaimana hasil pada katod dan anod terbentuk.
(f) Tuliskan persamaan ion keseluruhan yang mewakili elektrolisis.
Jawapan:
Keputusan:

1. (a) $$ \text { Ion } \mathrm{Cu}^{2+} \text {, ion } \mathrm{SO}_4^{2-} \text {, ion } \mathrm{H}^{+} \text {, ion } \mathrm{OH}^{-} $$
1. (b) $$ \text { Ion } \mathrm{H}^{+} \text {, ion } \mathrm{SO}_4^{2^{-}} \text {, ion } \mathrm{OH}^{-} $$
2.
Larutan kuprum(II) sulfat
 $$
2 \mathrm{Cu}^{2+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{Cu}+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
$$
2 \mathrm{Cu}^{2+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{Cu}+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
Asid sulfurik
 $$
4 \mathrm{H}^{+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{H}_2+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
$$
4 \mathrm{H}^{+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{H}_2+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
Tujuan : Mengkaji elektrolisis larutan akueus kuprum(II) sulfat, CuSO4 dan asid sulfurik, H2SO4 cair dengan menggunakan elektrod karbon.
Bahan : Larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 dan asid sulfurik, H2SO4 0.1 mol dm−3.
Radas : Sel elektrolisis, bateri, elektrod karbon, wayar penyambung dengan klip buaya, suis, ammeter, tabung uji dan kayu uji.
Prosedur:
1. Tuangkan larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 ke dalam sel elektrolisis sehingga setengah penuh.
2. Isikan dua tabung uji dengan larutan kuprum(II) sulfat, CuSO4 0.1 mol dm−3 sehingga penuh dan telangkupkan tabung uji itu ke atas elektrod karbon dalam sel elektrolisis.
3. Sambungkan elektrod karbon kepada suis, ammeter dan bateri dengan wayar penyambung untuk melengkapkan litar seperti pada Rajah 1.27.

4. Hidupkan suis selama beberapa minit.
5. Perhatikan dan rekodkan perubahan yang berlaku pada anod dan katod.
6. Lakukan ujian pengesahan pada gas yang dikumpulkan:
(a) Masukkan kayu uji berbara ke dalam tabung uji pada anod.
(b) Letak kayu uji bernyala ke dalam tabung uji pada katod.
7. Ulangi langkah 1 hingga 6 dengan menggunakan asid sulfurik, H2SO4 0.1 mol dm−3.
8. Rekodkan pemerhatian.
Keputusan:
Rekodkan semua pemerhatian dalam jadual di bawah.

Perbincangan:
1. Nyatakan ion-ion yang hadir dalam larutan akueus:
(a) Larutan kuprum(II) sulfat, CuSO4.
(b) Asid sulfurik, H2SO4.
2. Bagi larutan kuprum(II) sulfat, CuSO4 dan asid sulfurik, H2SO4 :
(a) Namakan ion yang bergerak ke katod dan anod semasa elektrolisis.
(b) Kenal pasti ion yang dinyahcas pada katod dan anod. Berikan sebab kepada jawapan anda.
(c) Namakan hasil yang terbentuk pada katod dan anod.
(d) Tuliskan setengah persamaan yang berlaku pada katod dan anod.
(e) Terangkan bagaimana hasil pada katod dan anod terbentuk.
(f) Tuliskan persamaan ion keseluruhan yang mewakili elektrolisis.
Jawapan:
Keputusan:

1. (a) $$ \text { Ion } \mathrm{Cu}^{2+} \text {, ion } \mathrm{SO}_4^{2-} \text {, ion } \mathrm{H}^{+} \text {, ion } \mathrm{OH}^{-} $$
1. (b) $$ \text { Ion } \mathrm{H}^{+} \text {, ion } \mathrm{SO}_4^{2^{-}} \text {, ion } \mathrm{OH}^{-} $$
2.
Larutan kuprum(II) sulfat
 $$
2 \mathrm{Cu}^{2+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{Cu}+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
$$
2 \mathrm{Cu}^{2+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{Cu}+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$Asid sulfurik
 $$
4 \mathrm{H}^{+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{H}_2+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$
$$
4 \mathrm{H}^{+}+4 \mathrm{OH}^{-} \rightarrow 2 \mathrm{H}_2+\mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O}
$$