- Ikatan datif juga dikenali sebagai ikatan koordinat.
- Ia adalah sejenis ikatan kovalen di mana dua atom berkongsi elektron yang berasal dari satu atom sahaja.
- Contoh-contoh pembentukan ikatan datif:
Ion ammonium, \(NH _{4}{ }^{+}\)- Apabila ammonia terlarut dalam air, ia mengion menghasilkan ion ammonium, \(NH _{4}^{+}\) dan ion hidroksida, \(OH^{-}\).
\[NH _{3}+ H _{2} O \rightarrow NH _{4}^{+}+ OH ^{-}\] - Ion ammonium, \(NH _{4}^{+}\) terbentuk apabila molekul ammonia membentuk ikatan datif dengan ion hidrogen di dalam air.
- Dalam molekul ammonia, atom nitrogennya mempunyai sepasang elektron bebas (elektron yang tidak dikongsi dengan atom lain).
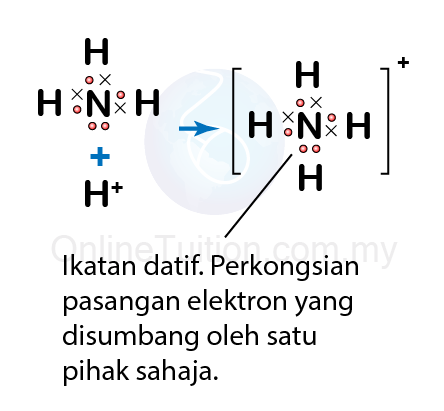
- Atom nitrogen menyumbangkan pasangan elektron bebas ini untuk berkongsi dengan ion hidrogen di dalam air dan membentuk satu ikatan kovalen.
- Ikatan kovalen yang tebentuk ialah ikatan datif di mana atom nitrogen dalam molekul ammonia berkongsi sepasang elektron bebas dengan nukleus hidrogen.
- Apabila ammonia terlarut dalam air, ia mengion menghasilkan ion ammonium, \(NH _{4}^{+}\) dan ion hidroksida, \(OH^{-}\).
Ion hidroksonium, \(H _{3} O^{+}\)
- Gas hidrogen klorida melarut dalam air membentuk ion hidroksonium, \(H _{3} O ^{+}\) dan ion klorida, \(Cl^{-}\).
\[HCl + H _{2} O \rightarrow H _{3} O ^{+}+ OH ^{-}\] - Ion hidroksonium, \(H _{3} O ^{+}\) terbentuk apabila molekul air bergabung dengan ion hidrogen \(H^{+}\).
- Atom oksigen dalam molekul air mempunyai dua pasang elektron bebas.
- Atom oksigen ini menyumbangkan sepasang elektron bebas untuk perkongsian dengan ion hidrogen \(H^{+}\).
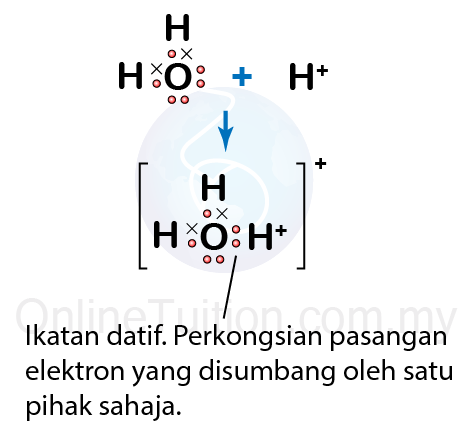
- Ikatan kovalen yang terbentuk ialah ikatan datif di mana atom oksigen dalam molekul air berkongsi sepasang elektron bebas dengan ion hidrogen \(H^{+}\).
