Soalan 1:
Salin dan lengkapkan peta pokok dengan menulis persamaan kimia bagi setiap tindak balas penambahan yang berlaku ke atas etena, C2H4.
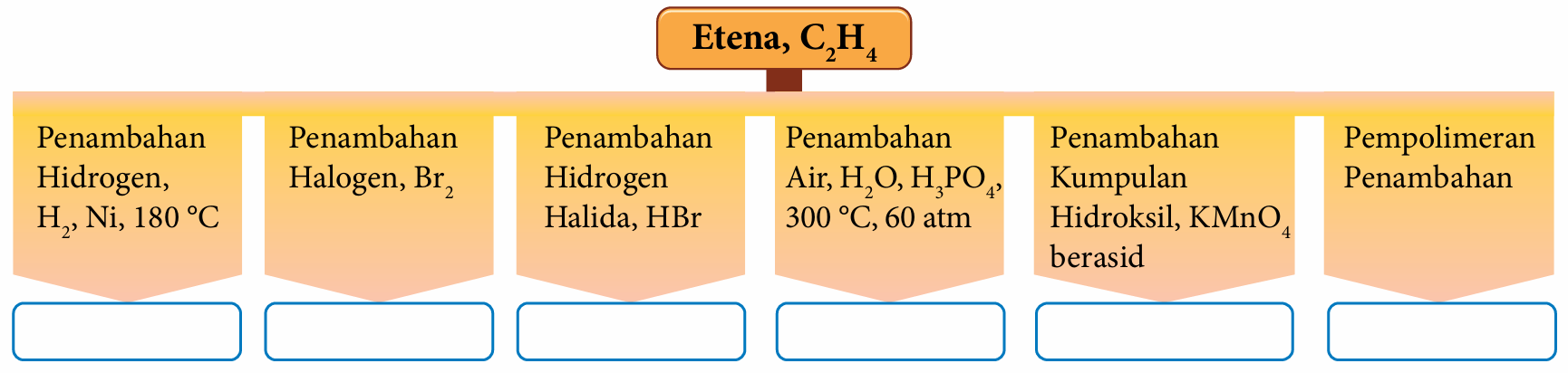
Jawapan:
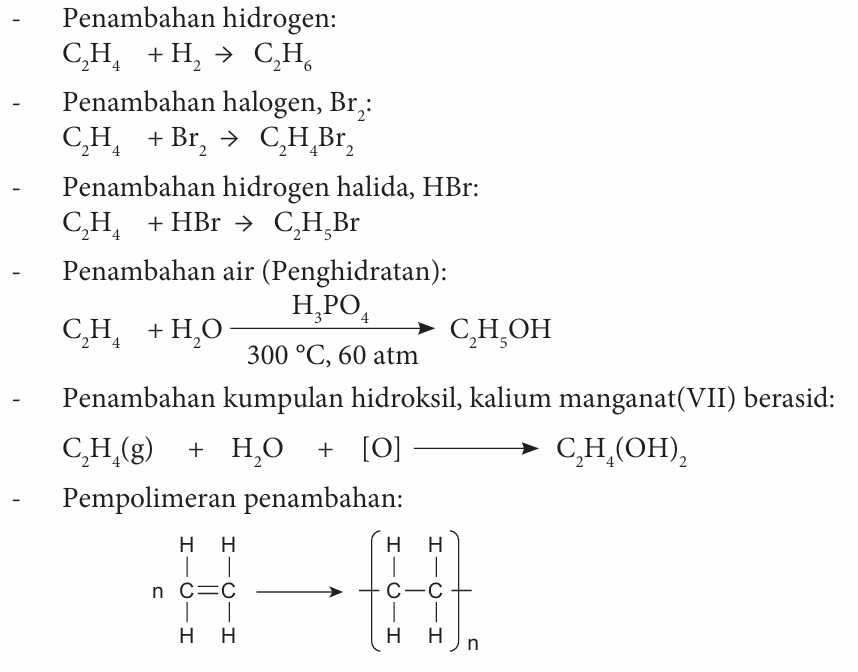
di mana n ialah sebarang nilai integer yang sangat besar.
Salin dan lengkapkan peta pokok dengan menulis persamaan kimia bagi setiap tindak balas penambahan yang berlaku ke atas etena, C2H4.

Jawapan:

di mana n ialah sebarang nilai integer yang sangat besar.
Soalan 2:
Heksana, C6H14 dan heksena C6H12 merupakan cecair tidak berwarna.
(a) Nyatakan perbezaan pemerhatian apabila kedua-dua cecair dibakar dalam oksigen berlebihan. Terangkan sebab berlakunya perbezaan tersebut.
(b) Selain pembakaran, huraikan satu ujian kimia yang dapat dijalankan untuk membezakan kedua-dua cecair ini.
Jawapan:
(a)
– Heksena terbakar dengan lebih berjelaga berbanding heksana.
$$ \begin{aligned} & \% \mathrm{C} \text { dalam heksana }=\frac{6(12)}{6(12)+14(1)} \times 100 \%=83.72 \% \\ & \% \mathrm{C} \text { dalam heksena }=\frac{6(12)}{6(12)+12(1)} \times 100 \%=85.71 \% \end{aligned} $$
– Peratus jisim karbon per molekul dalam heksena lebih tinggi dari heksana.
(b)
1. Masukkan sebanyak 2 cm3 heksana ke dalam tabung uji.
2. Tambah 2 – 3 titik air bromin dalam 1,1,1-triklrotroetana kepada heksana.
3. Goncang campuran.
4. Rekodkan semua pemerhatian.
5. Langkah 1 hingga 4 diulang menggunakan heksena menggantikan heksana.
Pemerhatian:
– Heksena menyahwarnakan warna perang air bromin.
– Heksana tidak menyahwarnakan warna perang air bromin.
Heksana, C6H14 dan heksena C6H12 merupakan cecair tidak berwarna.
(a) Nyatakan perbezaan pemerhatian apabila kedua-dua cecair dibakar dalam oksigen berlebihan. Terangkan sebab berlakunya perbezaan tersebut.
(b) Selain pembakaran, huraikan satu ujian kimia yang dapat dijalankan untuk membezakan kedua-dua cecair ini.
Jawapan:
(a)
– Heksena terbakar dengan lebih berjelaga berbanding heksana.
$$ \begin{aligned} & \% \mathrm{C} \text { dalam heksana }=\frac{6(12)}{6(12)+14(1)} \times 100 \%=83.72 \% \\ & \% \mathrm{C} \text { dalam heksena }=\frac{6(12)}{6(12)+12(1)} \times 100 \%=85.71 \% \end{aligned} $$
– Peratus jisim karbon per molekul dalam heksena lebih tinggi dari heksana.
(b)
1. Masukkan sebanyak 2 cm3 heksana ke dalam tabung uji.
2. Tambah 2 – 3 titik air bromin dalam 1,1,1-triklrotroetana kepada heksana.
3. Goncang campuran.
4. Rekodkan semua pemerhatian.
5. Langkah 1 hingga 4 diulang menggunakan heksena menggantikan heksana.
Pemerhatian:
– Heksena menyahwarnakan warna perang air bromin.
– Heksana tidak menyahwarnakan warna perang air bromin.
