Elektrolisis
- Elektrolisis ialah proses penguraian elektrolit kepada unsur juzuknya apabila arus elektrik mengalir melaluinya.
- Bila satu sebatian ion yang ringkas dielektrolisiskan, logam terbentuk di katod dan bukan logam di anod.
- Misalan dalam elektrolisis kalium iodida, kalium terbentuk di katod dan iodin terbentukdi anod.
Elektrod-elektrod
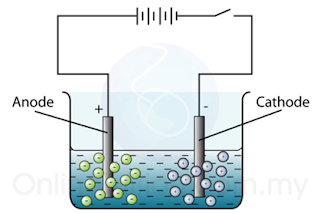
- Elektrod adalah rod-rod grafit atau kepingan-kepingan logam yang dicelupkan ke dalam sesuatu elektrolit.
- Arus elektrik masuk ke dalam elektrolit dan keluar darinya melalui elektrod.
- Anod ialah elektrod positif (ia disambungkan kepada terminal positif bateri).
- Katod ialah elektrod negatif (ia disambungkan kepada terminal negatif bateri).
Penerangan
(ion-ion negatif bergerak ke anod manakala ion positif bergerak ke katod)
- Elektrolisis berlaku apabila arus elektrik mengalir melalui suatu elektrolit.
- Suatu elektrolit mempunyai ion-ion yang bebas bergerak.
- Semasa elektrolisis, ion-ion positif bergerak ke katod (elektrod negatif) manakala ion-ion negatif bergerak ke anod (elektrod positif).
- Di anod, ion-ion negatif dinyahcaskan dengan menderma elektronnya.
- Elektron-elektron itu mengalir ke katod melalui wayar.
- Di katod, ion-ion positif menerima elektron-elektron dari elektrod dan dinyahcaskan.
- Proses ini menyebabkan elektrolit diuraikan.
Perubahan Tenaga Semasa Elektrolisis
- Dalam proses elektrolisis, tenaga elektrik dialirkan ke dalam elektrolit bagi menghasilkan tindak balas kimia.
- Oleh itu, semasa elektrolisis, tenaga elektrik ditukarkan kepada tenaga kimia.
Elektrolisis Sebatian Ion Lebur
Elektrolisis Leburan Plumbum Bromida
- Rajah di atas menunjukkan alat radas yang digunakan untuk mengkaji proses elektrolisis plumbum(II) bromida.
- Dalam elektrolisis, plumbum (II) bromida dilebur untuk menghasilkan ion-ion Pb2+ dan Br–
- Proses elektrolisis bermula sebaik sahaja pepejal plumbum(II) bromida mula melebur.
Di Katod
Ion yang hadir:
Pb2+
Pemerhatian
Butir-butir plumbum terbentuk di katod.
Penerangan
Ion plumbum (II), Pb2+ dinyahcaskan dengan menerima 2 elektron daripada elektrod dan membentuk logam plumbum.
Persamaan Separuh
Pb2+ + 2e —> Pb
Di Anod
Ion yang hadir:
Br–
Pemerhatian
Gas berbau sengit dan berwarna perang kemerahan dibebaskan.
Penerangan
Ion bromida, Br– dinyahcaskan dengan melepaskan satu elektron dan membentuk atom bromin. Dua atom bromin bergabung membentuk molekul bromin, Br2.
Persamaan Separuh
2Br– —> Br2 + e
Persamaan Kimia Keseluruhan
PbBr2 —> Pb + Br2