Takat Lebur dan Takat Didih
| Nama | Nomber Proton | Takat Lebur | Takat Didih |
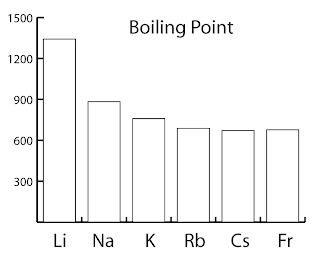
| Litium | 3 | 180ºC | 1342ºC |
| Natrium | 11 | 98ºC | 883ºC |
| Kalium | 19 | 63ºC | 759ºC |
| Rubidium | 37 | 39ºC | 688ºC |
| Sasium | 55 | 29ºC | 671ºC |
| Fransium | 87 | 27ºC | 677ºC |
Seperti yang ditunjukkan di dalam rajah di sebelah kanan, takat lebur dan takat didih logam alkali menurun apabila menuruni kumpulan.
Penerangan
- Atom-atom bagi logam alkali diikat antara satu sama lain oleh satu daya yang dinamakan sebagai ikatan logam.
- Kekuatan ikatan logam bergantung kepada jarak di antara atom. Semakin dekat atom-atom, semakin kuat ikatan logam ini.
- Apabila menuruni kumpulan, saiz atom bertambah. Oleh itu, jarak di antara atom bertambah.
- Pada hakikatnya, kekuatan ikatan logam di antara atom-atom berkurang, dan tenaga yang diperlukan untuk mengatasi ikatan ini semasa peleburan atau pendidhan juga berkurang dan seterusnya takat lebur/didih berkurang.
Ketumpatan
| Nama | Nomber Proton | Ketumpatan g/cm3 |
| Litium | 3 | 0.53 |
| Natrium | 11 | 0.97 |
| Kalium | 19 | 0.86 |
| Rubidium | 37 | 1.48 |
| Sasium | 55 | 1.87 |
| Fransium | 87 | > 1.87 |
- Ketumpatan logam kumpulan adalah lebih rendah berbanding dengan logam yang lain.
- Ketumpatan litium, natrium dan kalium adalah lebih rendah daripada air. Oleh itu mereka boleh terapung di atas permukaan air.
- Bagaimanapun, apabila menuruni kumpulan, ketumpatan logam alkali bertambah.