Soalan 1:
Adakah berlaku tindak balas redoks bagi setiap tindak balas di bawah ini?
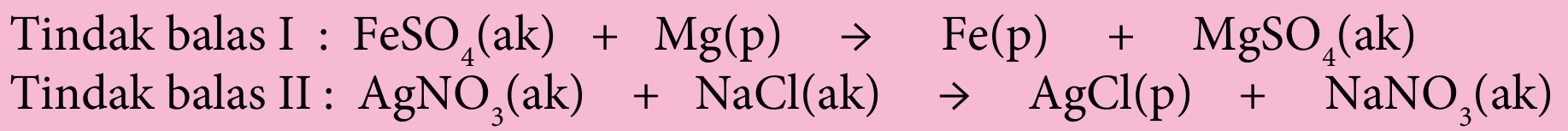
Kenal pasti dan terangkan jawapan anda berdasarkan perubahan nombor pengoksidaan.
Jawapan:
Tindak balas I adalah tindak balas redoks.
– Nombor pengoksidaan ferum sebelum tindak balas ialah +2 dan selepas tindak balas ialah 0.
– Nombor pengoksidaan magnesium sebelum tindak balas ialah 0 dan selepas tindak balas ialah +2.
– Magnesium mengalami tindak balas pengoksidaan kerana nombor pengoksidaan magnesium bertambah daripada 0 kepada +2.
– Ferum(II) sulfat mengalami tindak balas penurunan kerana nombor pengoksidaan ferum dalam ferum(II) sulfat berkurang daripada +2 kepada 0.
Tindak balas II bukan tindak balas redoks
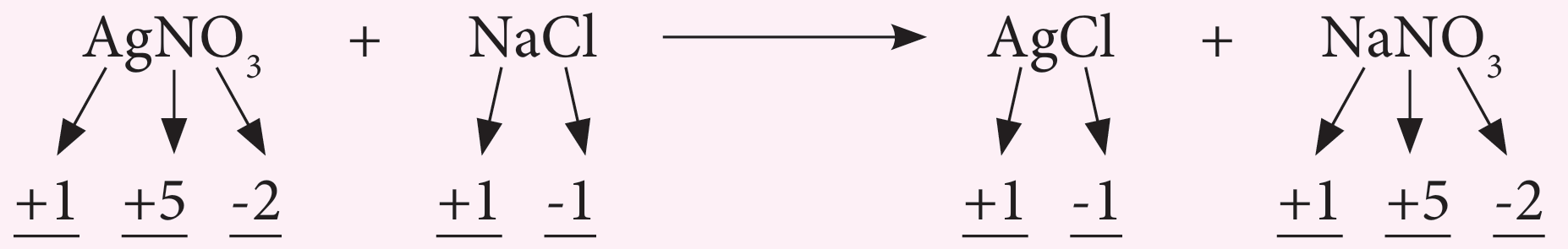
– Nombor pengoksidaan semua unsur argentum, nitrogen, oksigen, natrium dan klorin tidak berubah sebelum dan selepas tindak balas.
Adakah berlaku tindak balas redoks bagi setiap tindak balas di bawah ini?
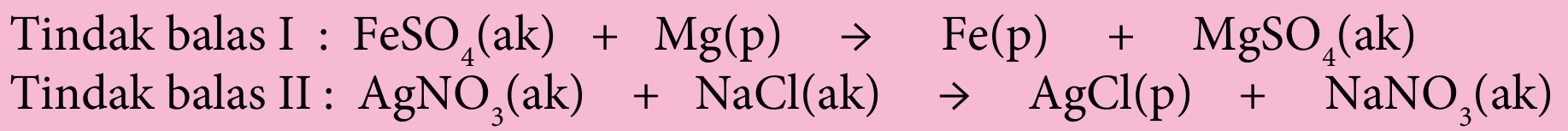
Kenal pasti dan terangkan jawapan anda berdasarkan perubahan nombor pengoksidaan.
Jawapan:
Tindak balas I adalah tindak balas redoks.
– Nombor pengoksidaan ferum sebelum tindak balas ialah +2 dan selepas tindak balas ialah 0.
– Nombor pengoksidaan magnesium sebelum tindak balas ialah 0 dan selepas tindak balas ialah +2.
– Magnesium mengalami tindak balas pengoksidaan kerana nombor pengoksidaan magnesium bertambah daripada 0 kepada +2.
– Ferum(II) sulfat mengalami tindak balas penurunan kerana nombor pengoksidaan ferum dalam ferum(II) sulfat berkurang daripada +2 kepada 0.
Tindak balas II bukan tindak balas redoks

– Nombor pengoksidaan semua unsur argentum, nitrogen, oksigen, natrium dan klorin tidak berubah sebelum dan selepas tindak balas.
Soalan 2:
Persamaan ion keseluruhan yang berikut menunjukkan tindak balas antara iodin, I2 dan sulfur dioksida, SO2.
$$ \mathrm{I}_2(\mathrm{ak})+\mathrm{SO}_2(\mathrm{~g})+2 \mathrm{H}_2 \mathrm{O}(\mathrm{ce}) \rightarrow 2 \mathrm{I}^{-}(\mathrm{ak})+\mathrm{SO}_4^{2-}(\mathrm{ak})+4 \mathrm{H}^{+}(\mathrm{ak}) $$
Berdasarkan persamaan di atas:
(a) Nyatakan perubahan nombor pengoksidaan bagi iodin dan sulfur.
(b) Namakan agen pengoksidaan dan agen penurunan dalam tindak balas ini.
(c) Tuliskan setengah persamaan penurunan.
Jawapan:
(a)
Nombor pengoksidaan iodin berkurang daripada 0 kepada -1.
Nombor pengoksidaan sulfur dalam sulphur dioksida bertambah daripada +4 kepada +6.
(b)
Agen pengoksidaan : Iodin.
Agen penurunan : Sulfur dioksida.
(c) I2 + 2e− → 2I−
Persamaan ion keseluruhan yang berikut menunjukkan tindak balas antara iodin, I2 dan sulfur dioksida, SO2.
$$ \mathrm{I}_2(\mathrm{ak})+\mathrm{SO}_2(\mathrm{~g})+2 \mathrm{H}_2 \mathrm{O}(\mathrm{ce}) \rightarrow 2 \mathrm{I}^{-}(\mathrm{ak})+\mathrm{SO}_4^{2-}(\mathrm{ak})+4 \mathrm{H}^{+}(\mathrm{ak}) $$
Berdasarkan persamaan di atas:
(a) Nyatakan perubahan nombor pengoksidaan bagi iodin dan sulfur.
(b) Namakan agen pengoksidaan dan agen penurunan dalam tindak balas ini.
(c) Tuliskan setengah persamaan penurunan.
Jawapan:
(a)
Nombor pengoksidaan iodin berkurang daripada 0 kepada -1.
Nombor pengoksidaan sulfur dalam sulphur dioksida bertambah daripada +4 kepada +6.
(b)
Agen pengoksidaan : Iodin.
Agen penurunan : Sulfur dioksida.
(c) I2 + 2e− → 2I−
