- Kakisan logam = logam kehilangan elektronnya untuk membentuk ion positif.
Contoh
Kakisan besi (forum)Fe → Fe2+ + 2eKakisan Magnesium
Mg → Mg2+ + 2e - Semakin tinggi kedudukan logam dalam siri elektrokimia, semakin elektropositif (reaktif) logam itu.
- Logam mempunyai kecenderungan yang lebih besar untuk melepaskan elektron untuk membentuk ion logam, iaitu logam lebih mudah terkakis.
- Sebagai contoh, logam magnesium logam lebih mudah terkakis berbanding dengan kuprum kerana magnesium lebih elektroposif daripada tembaga.
- Kakisan logam adalah tindak balas redoks kerana logam kehilangan elektron kepada oksigen dan air (yang bertindak sebagai agen pengoksidaan untuk menerima elektron).
- Kakisan besi juga dipanggil berkarat.Fe (s) → Fe2+ (aq) + 2e
- Pengaratan besi hanya boleh berlaku jika kedua-dua oksigen dan air hadir.
Pengaratan Besi
- Semasa pengaratan besi, besi bertindak sebagai agen penurunan manakala gas oksigen sebagai agen pengoksidaan.
- Proses pengaratan besi boleh dijelaskan dengan menggunakan rajah di bawah.
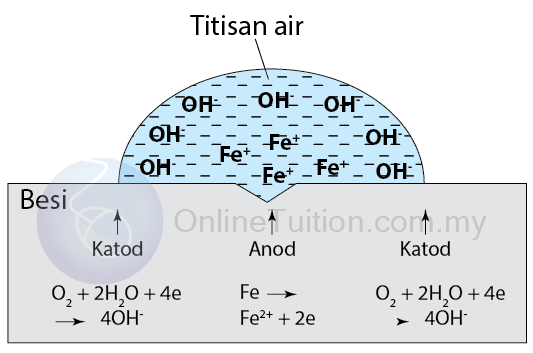
- Apabila permukaan besi terdedah kepada titisan air, pusat titisan air mengalami proses pengoksidaan dan bertindak sebagai anod.
- Pinggir titisan air mengalami proses penurunan dan bertindakan sebagai katod. (Pinggir titisan air bertindak sebagai katod kerana kepekatan oksigen yang terlarut lebih tinggi di pinggir titisan air daripada di bahagian tengah.)
- Di anod, besi logam mengalami pengoksidaan dan membentuk ion besi (II) dengan kehilangan elektron.Fe → Fe2+ + 2e
- Elektron yang bebas mengalir ke anod melalui logam besi ke kawasan katod di mana oksigen melarut dalam air dan menerima elektron untuk membentuk ion hidroksida.O2 + 2H2O + 4e → 4OH–
- Ion besi (II) kemudiannya bergabung dengan ion hidroksida untuk membentuk ferum(II) hidroksida.Fe2+ + OH- → Fe(OH)2
- Ferum(II) hidroksida kemudian dioksidakan oleh oksigen untuk membentuk ferum(III) hidroksida.4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
- Ferum(III) hidroksida kemudian diuraikan untuk membentuk ferum(III) oksida terhidrat, Fe2O3 • xH2O oleh oksigen di udara.4Fe(OH)3 → Fe2O3•xH2O
- Ferum(III) oksida terhidrat berwarna perang dan dikenali sebagai karat.
- Persamaan keseluruhan untuk pengaratan besi adalah
4Fe + 3O2 +2xH2O → 2Fe2O3•xH2O
