Aplikasi Elektrolisis Dalam Industri – Pengekstrakan Logam
- Rajah di bawah menunjukkan cara pengekstrakan logam bagi logam yang berlainan.
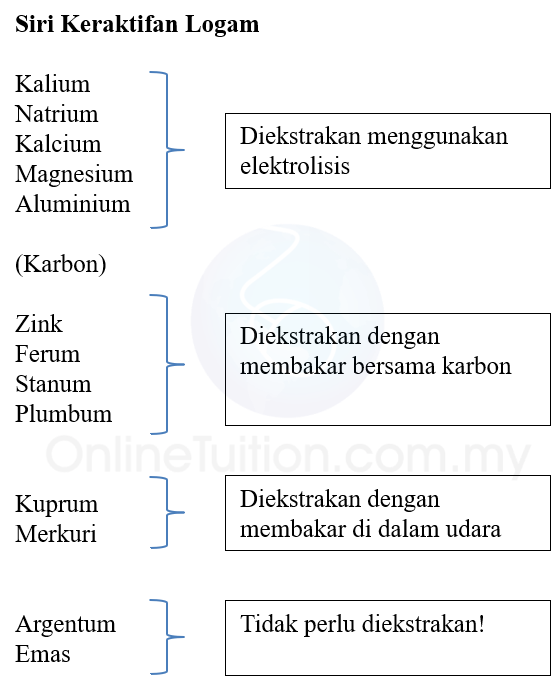
- Emas dan perak (argentum) tidak perlu diekstrakan kerana ia wujud dalam bentuk unsur di dalam alam semula jadi.
- Kuprum dan merkuri dapat diekstrakan dengan membakar sebatiannya di dalam udara.
- Bagi logam yang kurang reaktif daripada karbon seperti plumbum, stanum, ferum dan zink, ia diekstrakan daripada sebatiannya dengan cara penurunan oleh karbon.
- Logam-logam yang aktif seperti natrium, kalsium, atau aluminium diperolehi daripada sebatiannya melalui proses elektrolisis.
- Ini kerana logam-logam ini tidak dapat diekstrakkan
dengan cara penurunan oleh karbon.
Aplikasi Elektrolisis Dalam Industri – Pengekstrakan Aluminium

- Rajah di atas menunjukkan alat radas yang digunakan untuk pengekstrakan aluminium di dalam industri dengan menggunakan kaedah elektrolisis.
- Dalam SPM, anda perlu tahu
- jenis elektrolit yang digunakan.
- bahan yang digunakan sebagai anod dan katod
- tindak balas kimia di anod dan katod.
- mengapakah kriolit ditambah ke dalam bausit lebur?
- Grafit (Karbon) digunakan sebagai anod dan katod.
- Elektrod karbon perlu digantikan dari masa ke semasa kerana pada suhu setinggi 980oC, karbon bertindak balas dengan oksigen membentuk karbon dioksida.
- Aluminium ialah bahan yang terdapat dalam bausit.
- Bausit ditulenkan menjadi aluminium oksida, sejenis serbuk putih di mana aluminium boleh diekstrakkan.
- Kriolit dicampurkan ke dalam aluminuim oksida untuk merendahkan takat lebur aluminium oksida daripada 2000°C kepada 980°C.
Elektrolit:
Bausit lebur (Aluminium Oksida).
Al2O3→ 2Al3+ + 3O2-
Elektrod:
Anod: Grafit
Katod: Grafit
Tindakbalas Kimia
Anod:
2O2- → O2 + 4e
Ion oksida dinyahcaskan untuk membentuk gas oksigen. Gas oksigen dikumpulkan untuk kegunaan industri lain.
Katod
Al3++ + 3e → Al
Ion aluminium dinyahcaskan untuk membentuk logam aluminium
