- Tindak balas redoks berlaku apabila larutan suatu agen pengoksidaan bercampur dengan larutan agen penurunan.
- Sekiranya larutan agen pengoksidaan dan larutan agen penurunan dipisahkan oleh elektrolit dalam tiub-U, tindak balas redoks masih akan berlaku tetapi pemindahan elektron akan berlaku melalui wayar penghubung.
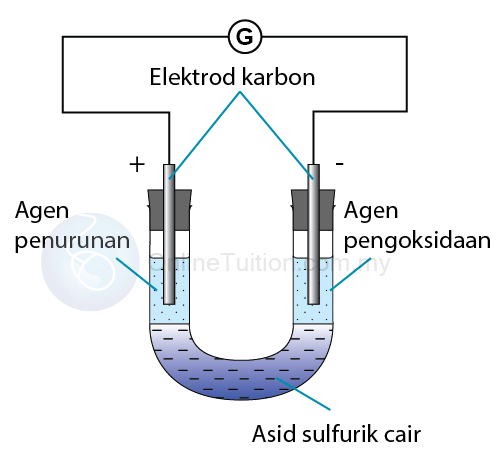
- Agen penurunan itu mengalami pengoksidaan dengan kehilangan elektron. Oleh itu, elektrod karbon yang direndam dalam larutan agen penurunan menjadi terminal sel negatif.
- Aliran elektron melalui wayar penghubung ke elektrod karbon yang direndam dalam larutan agen pengoksidaan. Elektrod karbon bertindak sebagai terminal sel positif.
- Agen pengoksida mengalami penurunan dengan penerimaan elektron.
Panduan untuk Menyelesaikan Masalah Berkaitan Pemindahan Elektron Pada Satu Jarak
- Pengoksidaan selalu berlaku di anod.
- Penurunan sentiasa berlaku di katod.
- Anod adalah terminal negatif.
- Katod adalah terminal positif.
Tindak Balas Di Antara Kalium Dikromat(VI) dan Kalium Iodida
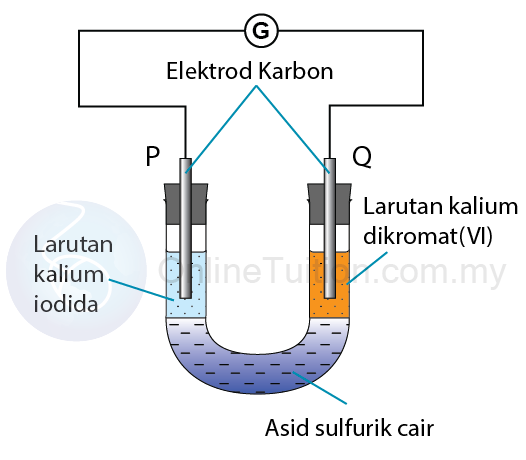
Langkah 1: Mengenalpasti agen pengoksidaan dan agen penurunan
Agen pengoksidaan: Kalium dikromat (VI)
Agen penurunan: Kalium iodida
Langkah 2: Menentukan proses pengoksidaan dan penurunan dan meramalkan pemerhatian
Pengoksidaan
Agen pengosidaan (kalium iodida) mengalami pengoksidaan
Pemerhatian: Larutan tanpa warna menjadi kuning/jingga.
Nota: Kalium iodida adalah larutan tidak berwarna manakala iodin berwarna kuning atau jingga apabila larut dalam air.
Penurunan
Agen pengoksida mengalami penurunan
Pemerhatian: Warna jingga larutan bertukar menjadi hijau.
Nota: Ion dikromat (VI) berwarna jingga manakala ion kromium (III) berwarna hijau
Langkah 3: Mengenal pasti anod dan katod
Elektrod P: Anod
Elektrod Q: Katod
Nota: Pengoksidaan berlaku di anod manakala penurunan terjadi di katod.
Langkah 4: Tentukan terminal positif dan negatif
Terminal positif: Elektrod Q
Terminal negatif: Elektrod P
Nota: Anod adalah terminal negatif manakala katod adalah terminal positif.
Langkah 5: Tentukan arah pengaliran elektron.
Dari elektrod P ke elektrod Q.
Nota: Aliran elektron dari terminal negatif ke terminal positif melalui dawai.
Tindak Balas Di Antara Ferum(II) Sulfat dan Air Bromin
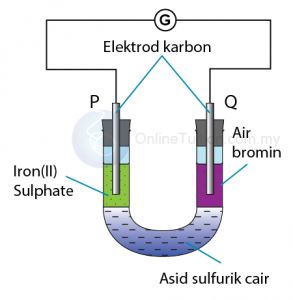
Langkah 1: Mengenalpasti agen pengoksidaan dan agen penurunan
Agen pengoksidaan: Air bromin
Agen penurunan: Ferum(II) sulfat
Langkah 2: Menentukan proses pengoksidaan dan penurunan dan meramalkan pemerhatian
Pengoksidaan
Agen penurunan mengalami pengoksidaan
Pemerhatian: Warna hijau larutan ferum(II) sulfat bertukar menjadi perang.
Nota: Ion ferum(II) berwarna hijau manakala ion ferum(III) berwarna perang
Penurunan
Agen pengoksidaan mengalami penurunan
Pemerhatian: Warna kuning/jingga air bromin menjadi tidak berwarna.
Nota: Bromin berwarna kuning/jingga dalam air manakala bromida tidak berwarna.
Langkah 3: Mengenal pasti anod dan katod
Elektrod P: Anod
Elektrod Q: Katod
Nota: Pengoksidaan berlaku di anod manakala penurunan terjadi di katod.
Langkah 4: Tentukan terminal positif dan negatif
Terminal positif: Elektrod Q
Terminal negatif: Elektrod P
Nota: Anod adalah terminal negatif manakala katod adalah terminal positif.
Langkah 5: Tentukan arah pengaliran elektron.
Dari elektrod P ke elektrod Q.
Nota: Aliran elektron dari terminal negatif ke terminal positif melalui dawai.
