Penyesaran Halogen Daripada Larutan Halide
- Halogen ialah unsur-unsur dalam Kumpulan 17 Jadual Berkala. Mereka ialah fluorin, klorin, bromin, iodin dan astatin.
- Semua halogen cenderung menerima satu elektron untuk membentuk ion negatif. Contohnya,
Cl2 + 2e → 2C1– - Ion-ion halogen dipanggil halida.
- Elektronegativiti halogen menurun apabila menuruni kumpulan, seperti ditunjukkan dalam carta di bawah:
- Halogen yang terletak di kedudukan yang lebih tinggi dalam kumpulan 17 adalah
- lebih elektronegatif
- bertindak sebagai agen pengoksidaan yang kuat
- boleh diturunkan dengan mudah
- Halogen yang berada pada kedudukan yang lebih tinggi dalam kumpulan 17 (lebih elektronegatif dan reaktif) boleh menyesarkan ion halida bagi unsur-unsur berada di bawahnya (yang kurang elektronegatif dan kurang reaktif) dalam jadual berkala.
- Apabila tindak balas penyesaran halogen berlaku:
- pemindahan elektron dari ion-ion halida yang terletak di bawah kumpulan 17 ke halogens yang diletakkan di kedudukan yang lebih tinggi.
- Halogens yang diletakkan dalam kumpulan 17 bertindak sebagai agen pengoksidaan.
- Halogen ini mengalami penurunan dan diturunkan menjadi ion halida.
- Ion halida yang diletakkan di kedudukan yang lebih rendah dalam kumpulan 17 bertindak sebagai agen penurunan.
- Ion-ion ini menjalani pengoksidaan dan dioksidakan kepada halogen.
Contoh
Tindak balas di antara larutan air klorin dan kalioum bromida.
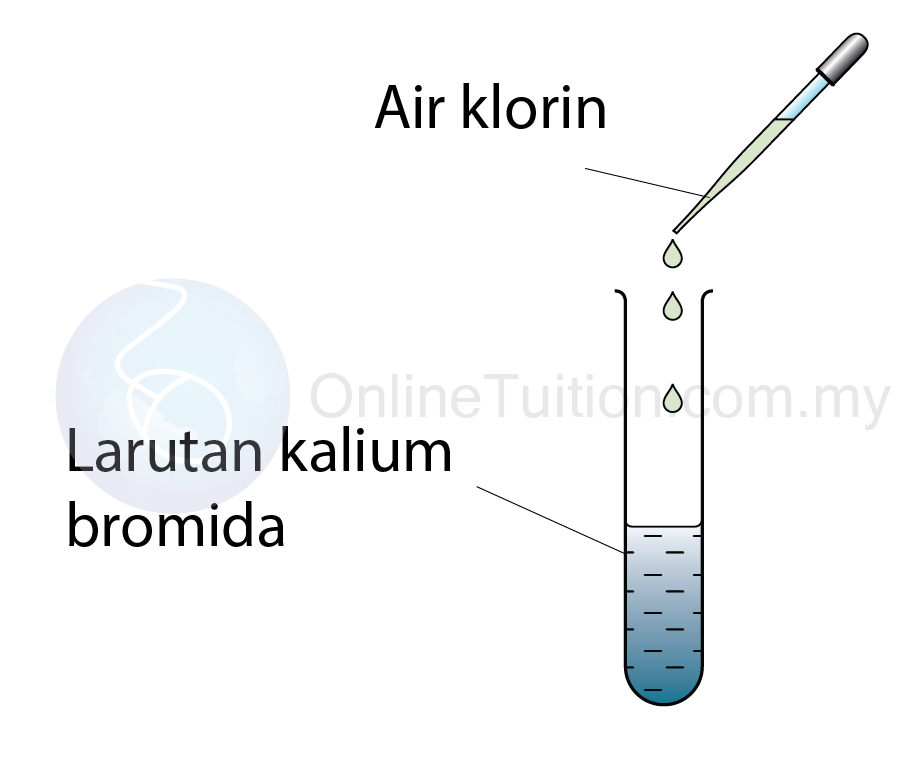
Prosedur
- Beberapa titis air klorin ditambah ke dalam 2 cm³ larutan kalium bromida.
- 2 cm³ tetraklorometana kemudiannya ditambah ke dalam campuran dan digoncangkan.
- Warna tetraklorometana (lapisan bawah) dicatatkan.
Pemerhatian:
Warna tetraklorometana berubah menjadi perang. Ini menunjukkan bahawa bromin hadir dalam larutan ini.
Persamaan Setengah:
2Br– → Br2 + 2e
Cl2 + 2e → 2Cl–
Persamaan:
Cl2 + 2Br– → 2Cl– + Br2
Nota:
- Klorin lebih elektronegatif daripada bromin.
- Dalam tindak balas, molekul klorin menyesarkan ion bromida dalam larutan.
- Ion bromida dioksidakan dengan melepaskan elektron untuk menjadi molekul bromin.
- Molekul klorin diturunkan dengan menerima elektron daripada ion bromida.
Agen pengoksidaan: Klorin
Agen penurunan: Bromida
Mengenal pasti Halogens dalam Satu Larutan
- Sekiranya halogen atau ion halida terlibat, biasanya ujian pengesahan diperlukan untuk memberi mengesahkan kehadiran halogen atau halida. Tetrachloromethane boleh digunakan dalam ujian pengesahan halogen.
- Ini boleh dilakukan dengan mencampurkan larutan halogen berair dalam sedikit tetraklorometana dan menggoncang. Dua lapisan akan terbentuk. Tetraklorometana yang lebih tumpat membentuk lapisan di bawah manakala larutan akueus membentuk lapisan di atas. Oleh itu, halogen yang hadir boleh disahkan oleh warna halogen dalam tetraklorometana.
- Identiti klorin, bromin dan iodin tidak dapat disahkan melalui warna larutan berair kerana warnanya berubah mengikut kepekatannya.
- Semua halida dalam air tidak berwarna. Sebagai contoh, larutan NaCl, NaBr, NaI, KCl, KBr dan KI tidak berwarna.
- Jadual di bawah menunjukkan warna halogen dalam larutan akueus dan tetraklorometana.
Klorin
| Warna dalam larutan akueus | Warna dalam tetraklorometana |
| Kuning pucat atau hampir tidak berwarna | Kuning pucat atau hampir tidak berwarna |
Bromin
| Warna dalam larutan akueus | Warna dalam tetraklorometana |
| Perang, perang kekuningan atau kuning, bergantung kepada kepekatan. | Perang atau kuning kemerahan bergantung kepada kepekatan. |
Iodin
| Warna dalam larutan akueus | Warna dalam tetraklorometana |
| Perang, perang kekuningan atau kuning, bergantung kepada kepekatan. | Ungu |
