Tindak balas redoks yang dikaji di dalam silibus SPM termasuk
- Tindak balas redoks melibatkan ion ferum(II) dan ion ferum(III)
- Tindak balas redoks melibatkan penyesaran logam daripada larutan garam
- Tindak balas redoks melibatkan penyesaran halogen daripada larutan garam
- Tindak balas redoks melibatkan pemindahan elektron pada suatu jarak
- Pengaratan sebagai suatu tindak balas redoks
Agen Pengoksidaan dan Agen Penurunan
- Dalam tindak balas redoks, sebatian yang diturunkan ialah agen pengoksida. Ajen pengoksida adalah bahan yang mengoksidakan sesuatu bahan yang lain.
- Sebaliknya, sebatian yang teroksida adalah agen penurunan. Agen penurunan menurunkan sesuatu bahan yang lain.
Contoh:
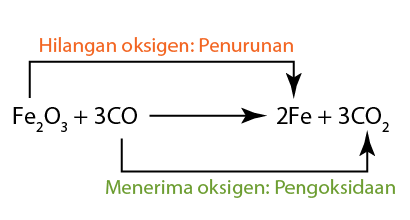
- ]Dalam tindak balas ini, ferum(III) oksida diturunkan. Oleh itu ia adalah agen pengoksida. Ia telah mengoksidakan karbon monoksida kepada karbon dioksida.
- Karbon monoksida teroksida. Oleh itu ia berfungsi sebagai agen penurunan. Ia telah menurunkan ferum(III) oksida untuk menjadi logam besi.
Contoh:
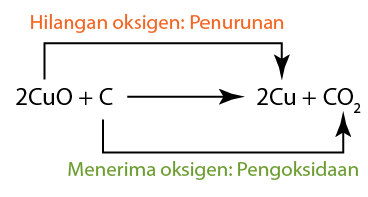
- Kuprum(II) oksida diturunkan, oleh itu ia adalah agen pengoksidaan.
- Karbon mengalami pengoksidaan, oleh itu ia adalah agen penurunan.
Agen Pengoksidaan/Penurunan Yang Biasa Digunakan
Berikut adalah agen pengoksidaan dan pengurangan yang biasa digunakan
Agen Pengoksidaan
Kalium Permanganat(VII) berasid
MnO4– + 8H+ + 5e → Mn2+ + 4H2O
Pemerhatian: Warna ungu kalium permanganat (VII) dilunturkan
Kalium dikromat(VI) berasid
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Pemenrhatian: Warna jingga kalium dikromat(VI) bertukar menjadi hijau.
Hidrogen peroksida
H2O2 + 2H+ + 2e → 2H2O
Asid nitrik pekat
NO3– + 4H+ + 3e → NO + 2H2O
Agen Penurunan
Sulfur Dioksida
SO2 + 2H2O → SO42- + 4H+ + 2e
Hidrogen Sulfida
H2S → 2H+ + S + 2e
Larutan Natrium Sulfit
SO32- + H2O → SO42- + 2H+ + 2e
Larutan Stanum(II) Klorida
Sn2+ → Sn4+ + 2e
