Molekul Dwikutub
Keelektronegatifan
- Keelektronegatifan ialah kecenderungan suatu atom menarik elektron ke arahnya.
- Semakin tinggi keelektronegatifan, semakin kuat suatu atom atau sebatian menarik elektron ke arahnya.
- Keelektronegatifan suatu atom dipengaruhi oleh nombor atomnya dan jarak elektron valens daripada nukleus atom.
- Florin, oksigen dan nitrogen ialah 3 unsur yang mempunyai keelektronegatifan paling tinggi di dalam jadual berkala.
Molekul Dwikutub
- Apabila satu atom berkongsi pasangan elektron dengan atom unsur yang sangat elektronegatif seperti nitrogen, oksigen dan fluorin, taburan elektron dalam molekul akan menjadi tidak sekata.
- Ini adalah kerana unsur yang lebih elektronegatif dalam molekul itu akan menarik pasangan elektron yang dikongsi itu mendekati nukleusnya.
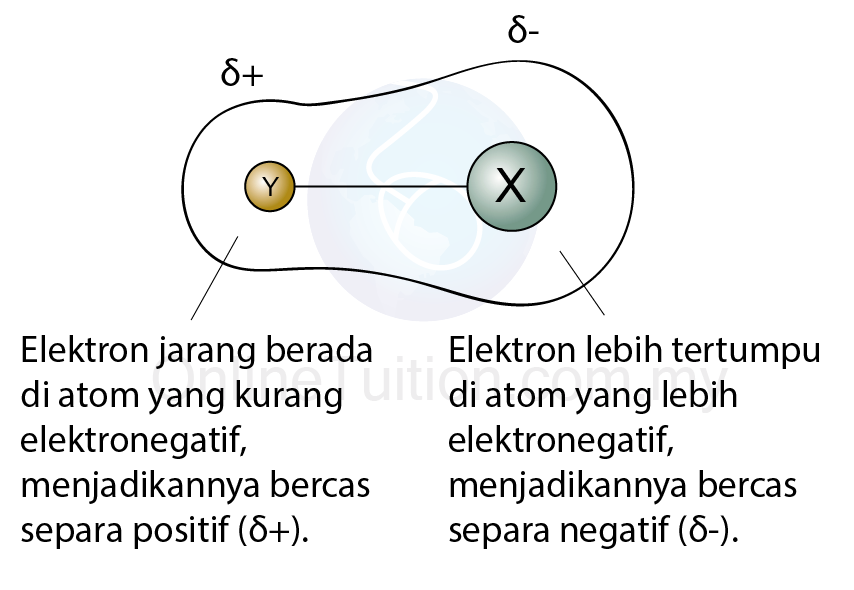
- Oleh itu, elektron lebih tertumpu di atom yang lebih elektronegatif, menyebabkan ia mempunyai cas negatif yang lebih tinggi. Kita kata atom itu menjadi cas separa negatif, \(\delta-\)
- Bagi atom yang kurang elektronegatif, pasangan elektron yang dikongsi adalah jauh daripadanya, maka ia akan menjadi cas separa positif, \(\delta+\).
- Rajah di bawah menunjukkan satu molekul dwikutub yang terdiri daripada unsur X yang lebih elektronegatif daripada unsur Y.
Pasangan Elektron Ikatan dan Pasangan Elektron Bebas
- Dalam satu molekul kovalen, bukan semua elektronvalens akan dikongsi untuk membentuk ikatan kovalen.
- Pasangan elektronvalens yang dikongsi antara 2 atom dinamakan sebagai pasangan elektron ikatan.
- Pasangan elektronvalens yang tidak dikongsi dengan atom lain dinamakan sebagai pasangan elektron bebas.
- Kedua-dua elektron dalam pasangan elektron bebas adalah lebih dekat antara satu sama lain berbanding dengan pasangan elektron ikatan, maka cas negatif bagi pasangan elektron bebas adalah lebih tumpat.
Ikatan Hidrogen
- Apabila atom hidrogen berkongsi pasangan elektron dengan atom unsur-unsur yang sangat elektronegatif seperti nitrogen, oksigen dan fluorin, ia akan membentuk molekul kovalen dwi-kutub.
- Dalam molekul dwi-kutub ini, atom hidrogen mempunytai cas separa positif \(\delta+\).
- Atom hidrogen bercas separa positif \(\delta+\) ini akan menghasilkan daya tarikan elektrostatik dengan pasangan elektron bebas dalam molekul lain.
- Daya tarikan yang terbentuk ini dinamakan sebagai ikatan hidrogen.
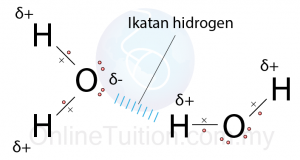
Ikatan Hidrogen Dalam Molekul Air
- Molekul air terdiri daripada satu atom oksigen dan 2 atom hidrogen.
- Nukleus atom oksigen mengandungi lapan proton bercas positif manakala atom hidrogen yang hanya mempunyai satu proton dalam nukleusnya.
- Oleh itu atom oksigen lebih cenderung menarik elektron berbanding dengan atom hidrogen, iaitu atom oksigen adalah lebih elektronegatif daripada atom hidrogen.
- Akibatnya, elektron-elektron ditarik lebih rapat ke arah atom oksigen dalam molekul air.
- Atom oksigen menjadi kutub bercas separa negatif, \(\delta\) – manakala atom hidrogen menjadi kutub bercas separa positif, \(\delta+\). Oleh itu, molekul air adalah molekul dwi-kutub.
- Atom hidrogen bercas separa positif, \(\delta+\) akan menarik pasangan elektron bebas daripada oksigen di molekul air yang lain dan membentuk ikatan hidrogen.
Syarat-syarat Bagi Pembentukan Ikatan Hidrogen
- Bukan semua molekul yang mempunyai atom hidrogen akan membentuk ikatan hidrogen.
- Hanya molekul yang memenuhi syarat-syarat berikut akan menghasilkan ikatan hidrogen.
- atom hidrogen di dalam molekul terikat kepada atom florin (F), oksigen (O) atau nitrogen (N).
- Molekul lain yang mempunyai pasangan elektron bebas.
