- Kedudukan karbon dalam siri kereaktifan logam boleh ditentukan berdasarkan:
- Keupayaan logam untuk mengambil oksigen dari oksida karbon, iaitu karbon dioksida.
- Keupayaan karbon untuk mengambil oksigen daripada oksida logam.
Eksperimen 1
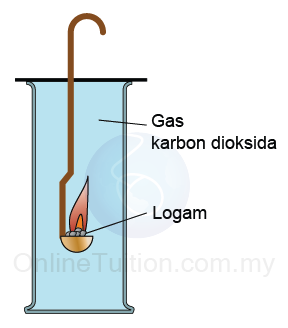
- Jika logam boleh mengambil oksigen daripada karbon dioksida, maka logam itu lebih reaktif daripada karbon.
Logam + karbon dioksida → logam oksida + karbon - Sebaliknya, jika logam tidak dapat mengambil oksigen daripada karbon dioksida, maka logam kurang reaktif daripada karbon.
Contoh
2Mg (s) + CO2(g) → 2MgO (s) + C (s)
Kesimpulan: Magnesium lebih reaktif daripada karbon kerana magnesium berupaya menyesarkan karbon daripada karbon dioksida.
Eksperimen 2
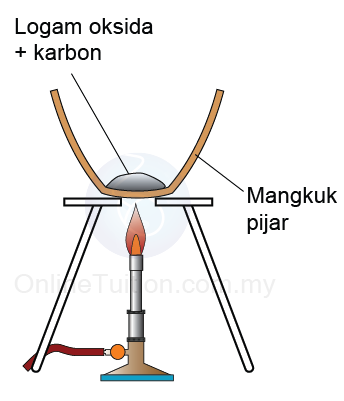
- Sekiranya karbon boleh mengambil oksigen daripada oksida logam, maka karbon lebih reaktif daripada logam.
Karbon + logam oksida → logam + karbon dioksida - Sebaliknya, jika karbon tidak dapat mengambil oksigen daripada satu logam oksida, maka karbon kurang reaktif daripada logam itu.
Contoh
C + 2CuO → 2Cu + CO2
Kesimpulan: Kuprum kurang reaktif daripada karbon kerana ia boleh disesarkan oleh karbon daripada oksidanya.
Kesimpulan: Kuprum kurang reaktif daripada karbon kerana ia boleh disesarkan oleh karbon daripada oksidanya.
Carta di bawah menunjukkan kedudukan karbon dalam siri kereaktifan.

