Pembentukan Ion
- Ion ialah zarah-zarah yang membawa cas positif atau cas negatif. Contohnya Ca2+, O2-, SO42- .
- Semua unsur kumpulan 1, 2, dan 13 mempunyai 1, 2 dan 3 elektron valens masing masing.
-
Dalam tindak balas kimia, atom-atom unsur ini cenderung untuk melapaskan semua elektron valens untuk mencapai susunan elektron gas adi yang stabil.
-
Selepas melepaskan elektron, bilangan protonnya melebihi bilangan elektron, maka atom itu akan membentuk ion positif.
- Atom-atom bukan logam daripada Kumpulan 15. 16, dan 17 Jadual Berkala masing-masing mempunyai 5, 6, dan 7 elektron valens.
- Dalam tindak balas kimia, atom-atom bukan logam ini cenderung untuk menerima elektron ke dalam petala terluar untuk mencapai susunan elektron gas adi yang stabil. Jadi, ion negatif ( anion ) terbentuk.
Pembentukan Ion Positif
- Ion positif biasanya terbentuk daripada atom logam.
- Atom-atom logam biasanya mempunyai 1, 2, dan 3 elektron valens.
- Dalam tindak balas kimia, atom-atom logam ini cenderung untuk melepaskan semua elektron valens (sama ada satu, dua, atau tiga elektron) untuk mencapai susunan elektron gas adi yang stabil.
- Selepas melepasi elektron, bilangan proton lebih banyak daripada bilangan elektron, iaitu jumlah cas positif melebihi jumlah cas negatif.
- Maka ion bercas positif (kation) terbentuk.
Contoh: Pembentukan Ion Bercas +1
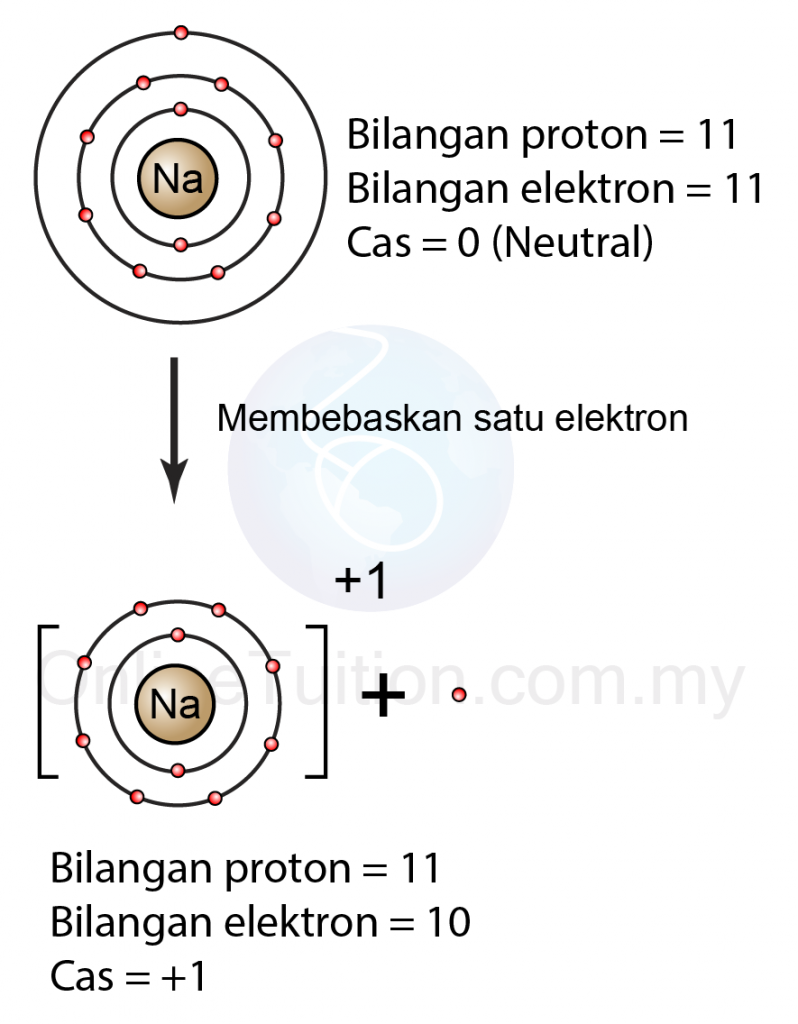 |
| (Atom natrium melepaskan satu elektron membentuk ion bercas +1) |
Contoh: Pembentukan Ion Bercas +2
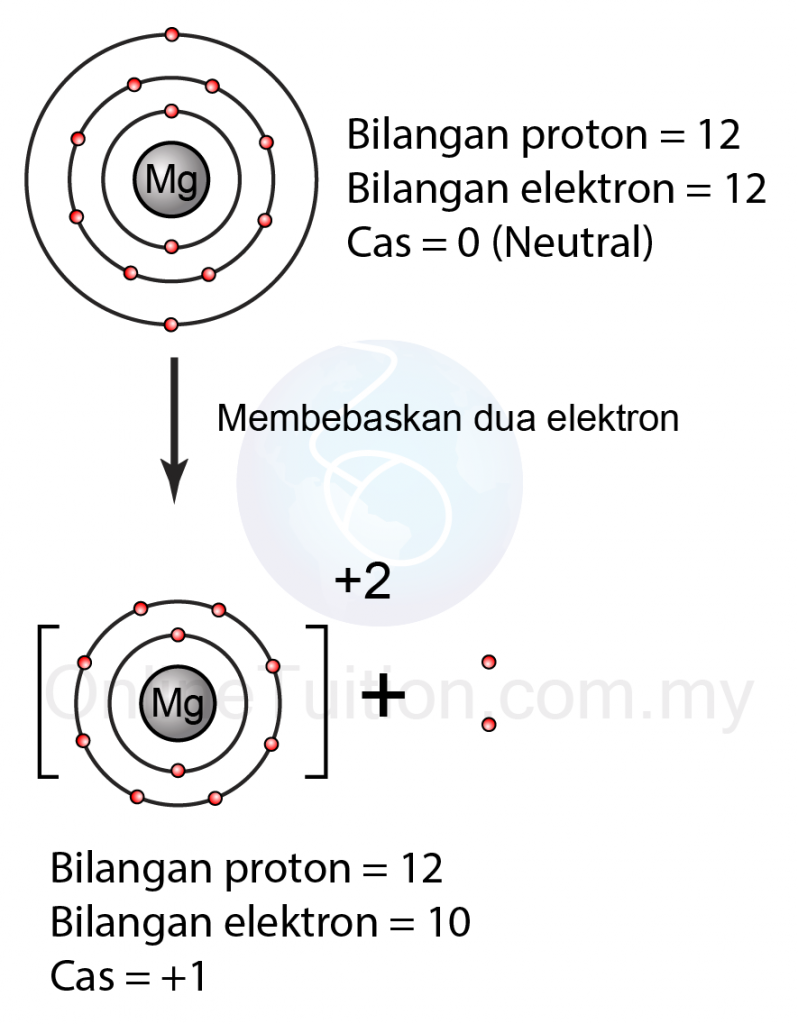 |
| (Atom magnesium melepaskan dua elektron membentuk ion bercas +2) |
Contoh: Pembentukan Ion Bercas +3
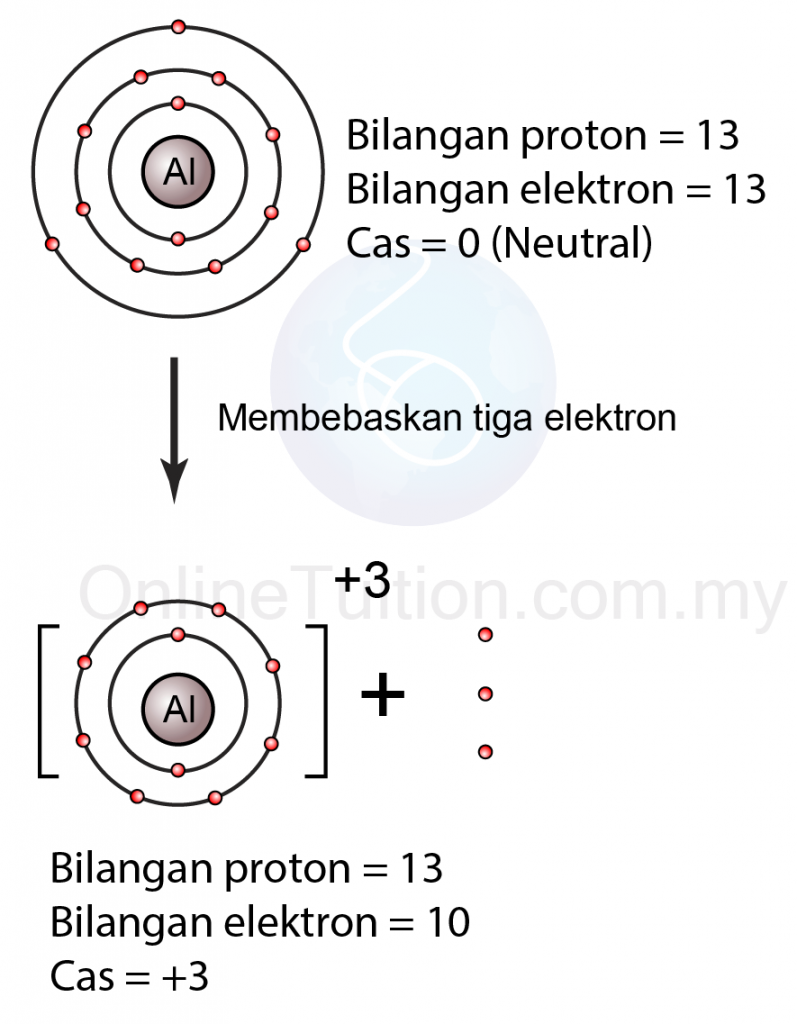 |
| (Atom aluminium melepaskan tiga elektron membentuk ion bercas +3) |
Pembentukan Ion Negatif
- Atom-atom bukan logam daripada. Kumpulan 15, 16, dan 17 Jadual Berkala masing-masing mempunyai 5, 6, dan 7 elektron valens.
- Dalam tindak balas kimia, atom-atom bukan logam ini cenderung untuk menerima elektron ke dalam petala terluar untuk mencapai susunan elektron gas adi yang stabil.
- Akibatnya, bilangan elektron melebihi bilangan potron di dalam zarah dan ion negatif (anion) terbentuk.
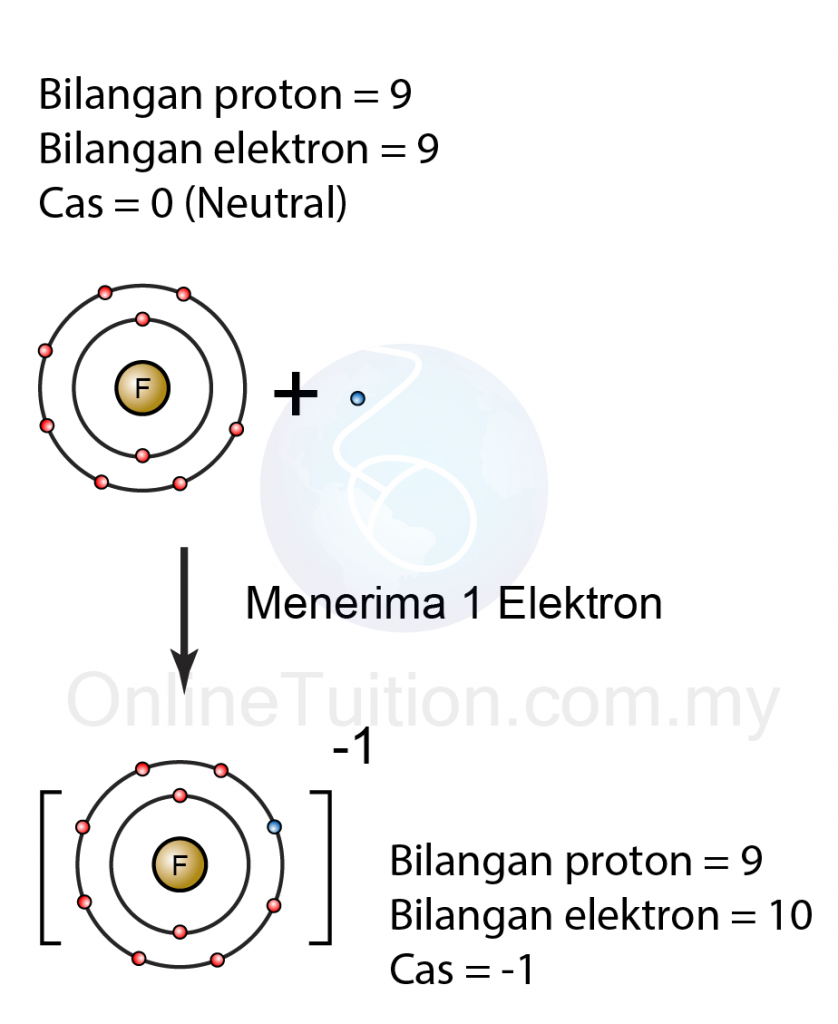
Pembentukan Ion Negatif Bercas -1
 |
| (Atom fluorin menerima satu elektron membentuk ion fluorida yang bercas -1) |
Pembentukan Ion Negatif Bercas -2
 |
| (Atom oksigen menerima dua elektron membentuk ion oksida yang bercas -2) |
Perbezaan di Antara Ion Fluorida dan Atom Neon
- Selepas pembentukan ion, susunan elektron ion itu adalah sama seperti susunan elektron gas adi.
- Contohnya, susunan elektron ion fluorida ialah 2.8, iaiitu sama seperti susunan elektron neon, 2.8.
- Kedua-dua ion fluorida dan atom neon mempunyai susunan elektron yang sama.
- Ion fluorida membawa cas manakala atom neon adalah neutral. Oleh itu, mereka adalah berbeza secara kimia.
 |
| (Susunan elektron ion fluorida adalah sama dengan susunan elektrom atom neon. Bagaimanapun, mereka adalah berbeza secara kimia.) |
