Susunan Elektron di Dalam Atom
- Dalam model atomnya, Neils Bohr mencadangkan bahawa elektron mesti berada di dalam orbit yang mempunyai tenaga tertentu yang dinamakan sebagai petala.
- Setiap petala boleh diisi oleh bilangan elektron yang terhad.
- Misalnya, petala pertama maksimumya boleh diisi oleh 2 elektron, petala kedua boleh diisi oleh 8 elektron dan petala ketiga boleh diisi oleh 18 elektron.
- Bagaimanapun, petala ketiga mencapai kestabilan maksimum apabila is diisi oleh 8 elektron. Oleh itu elektron ke-9 dan ke-10 akan diisi ke dalam petala keempat, dan bukan di dalam petala ketiga (Sila rujuk kepada susunan elektron argon, kalium dan kalsium dalam jadual di bawah..
- Susunan elektron bagi sesuatu atom ialah suatu susunan elektron yang menunjukkan bagaimana elektron-elektron dalam satu atom unsur ditempatkan dalam petala-petala yang mengelilingi nukleus.
- Contoh-contoh di bawah menunjukkan bagaimana elektron-elektron disusun bagi unsur-nunsur tertentu.
- Susunan elektron bagi 20 unsur pertama dalam Jadual Berkala dapat ditulis dengan mengikut langkah-langkah berikut:Langkah 1: Petala-petala elektron yang mengeliling nukleus dilabelkan dengan 1,2,3,4 atau K,L,M,N … mulai daripada petala yang terdekat degnan nukleus.
Langkah 2: Isikan petala yang terdekat
Langkah 3: Elektron diisi mengikut hadnya.
Petala 1 : 2 elektron
Petala 2 : 8 elektron
Petala 3 : 8 elektron
Petala 4 : …..
Atom | Nota | Susunan Elektron |
 |
| 2.1 |
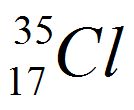 |
| 2.8.7 |
 |
| 2.8.8.2 |
Jadual di bawah menunjukkan susunan elektron bagi 20 unsur yang pertama dalam jadual berkala.
| Unsur | Nombor Proton | Bilangan elektron | Bilangan elektron di dalam | Susunan Elektron | |||
| petala pertama | petala kedua | petala ketiga | petala keempat | ||||
| Hidrogen | 1 | 1 | 1 | 0 | 0 | 0 | 1 |
| Helium | 2 | 2 | 2 | 0 | 0 | 0 | 2 |
| Litium | 3 | 3 | 2 | 1 | 0 | 0 | 2.1 |
| Berillium | 4 | 4 | 2 | 2 | 0 | 0 | 2.2 |
| Boron | 5 | 5 | 2 | 3 | 0 | 0 | 2.3 |
| Karbon | 6 | 6 | 2 | 4 | 0 | 0 | 2.4 |
| Nitrogen | 7 | 7 | 2 | 5 | 0 | 0 | 2.5 |
| Oksigen | 8 | 8 | 2 | 6 | 0 | 0 | 2.6 |
| Fluorin | 9 | 9 | 2 | 7 | 0 | 0 | 2.7 |
| Neon | 10 | 10 | 2 | 8 | 0 | 0 | 2.8 |
| Natrium | 11 | 11 | 2 | 8 | 1 | 0 | 2.8.1 |
| Magnesium | 12 | 12 | 2 | 8 | 2 | 0 | 2.8.2 |
| Aluminium | 13 | 13 | 2 | 8 | 3 | 0 | 2.8.3 |
| Silikon | 14 | 14 | 2 | 8 | 4 | 0 | 2.8.4 |
| Fosforus | 15 | 15 | 2 | 8 | 5 | 0 | 2.8.5 |
| Sulfur | 16 | 16 | 2 | 8 | 6 | 0 | 2.8.6 |
| Klorin | 17 | 17 | 2 | 8 | 7 | 0 | 2.8.7 |
| Argon | 18 | 18 | 2 | 8 | 8 | 0 | 2.8.8 |
| Kalium | 19 | 19 | 2 | 8 | 8 | 1 | 2.8.8.1 |
| Kalsium | 20 | 20 | 2 | 8 | 8 | 2 | 2.8.8.2 |
Elektron Valens
Elektron yang terletak di petala terluar dinamakan elektron valens.
- Elektron yang terletak di petala terluar dinamakan lektron valens.
- Bilangan elektron menentukan sifat kimia satu unsur.
- Unsur yang mempunyai bilangan elektron valens yang sama menunjukkan sifat kemia yang sama.
Contoh:
Berapakah bilangan elektron valens bagi natrium, 11Na; oksigen, 8O; Karbon, 12C dan Kalsium, 20Ca.
Berapakah bilangan elektron valens bagi natrium, 11Na; oksigen, 8O; Karbon, 12C dan Kalsium, 20Ca.
Jawapan:
Atom | Konfigurasi elektron | Elektron valens |
11Na | 2.8.1 | 1 |
8O | 2.6 | 6 |
12C | 2.8.2 | 2 |
20Ca | 2.8.8.2 | 2 |


