Kala
- Kala ialah baris unsur-unsur yang mendatar dalam Jadual Berkala.
- Jadual berkala moden mempunyai 7 kala.
- Nombor kala suatu unsur dalam Jadual Berkala adalah sama dengan bilangan petala atom unsur itu yang telah diisi dengan elektron.
- Unsur-unsur di dalam kala yang sama mempunyai bilangan petala yang sama yang diisi oleh elektron.
- Nombor proton bertambah dari kiri ke kanan merentasi kala.
- Oleh itu, bilangan elektron juga bertambah dari kiri ke kanan merentasi kala.
Siri Aktinida dan Siri Lantinida

- Kala ke-6 mempunyai 32 unsur. 14 unsur dalam kala ini diletakkan di bawah jadual utama kerana kekurangan ruang di dalam kala. Unsur-unsur ini dinamakan sebagai siri Lantinida.
- Begitu juga dengan kala ke-7, disebabkan kekurangan ruang dalam kala, 14 unsur diletakan di bawah jadual utama dan dinamakan sebagai siri Aktinida.
Perubahan Fizik Merentasi Kala
Terdapat beberapa perubahan fizik yang ketara merentasi kala dari kiri ke kanan. Contohnya
- perubahan keadaan fizik daripada pepejal ke pada gas
- perubahan saiz atom.
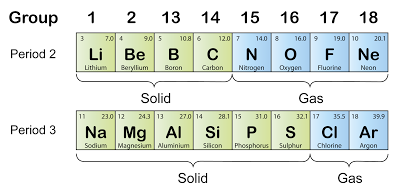
Keadaan Fizik
- Rajah di atas menunjukkan keadaan fizik bagi unsur-unsur dalam kala ke-2 dan ke-3.
- Didapati bahawa keadaan fizik unsur-unsur dalam kala ke-2 dan ke-3 berubah daripada pepejal kepada gas.
- Logam di sebelah kiri adalah pepejal dan bukan logam di sebelah kanan kebanyakannya adalah gas.
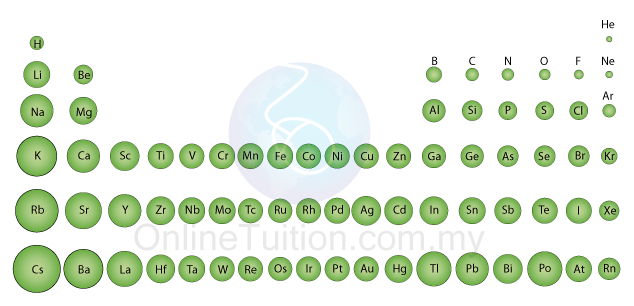
Saiz atom
- Rajah di atas menunjukkan perubhan saiz atom bagi kala ke-2 dan ke-3.
- Didapati bahawa saiz atom berkurang apabila merentasi kala dari kiri ke kanan. Ini adalah kerana
- Apabila merentasi kala ke-2 dan ke-3 dari kiri ke kanan, bilangan elektron semakin bertambah dalam petala ke-3.
- Pada masa yang sama, bilangan proton juga bertambah.
- Dengan ini, cas di dalam nukleus juga bertambah. Maka tarikannya terhadap elektronnya juga bertambah.
- Oleh itu, saiz atom semakin berkurang apabila merentasi kala dari kiri ke kanan.
- Rajah di bawah menunjukkan perbandingan saiz atom bagi unsur-unsur dalam jadual berkala. Kita dapat membuat kesimpulan bahawa
- saiz atom bertambah apabila menuruni kumpulan
- saiz atom berkurang apabila merentasi kala.
- tiada perubahan ketara bagi saiz atom unsur-unsur peralihan apabila merentasi kala.
Perubahan Kimia Merentasi Kala
Terdapat perubahan kimia yang beransur-ansur dari kiri ke kanan merentasi kala. Contohnya:
- Keasidan (atau kebesan) oksida unsur berubah merentasi kala
- Ciri logam unsur juga berubah merentasi kala
- keelktronegatifan juga berubah dari kiri ke kanan
Oksida Asid dan Oksida Bes
- Oksida bes adalah oksida logam yang boleh bertindak balas dengan asid membentuk garam dan air.
- Oksida asid adalah oksida bukan logam yang boleh bertindak balas dengan alkali membentuk garam dan air.
- Oksida amfoterik adalah oksida yang boleh bertindak balas dengan asid dan alkali untuk membentuk garam dan air .
- Dari kiri ke kanan merentasi kala, oksida unsur berubah daripada oksida bes (oksida logam, contohnya Na2O ) ke oksida asid (oksida bukan logam, contohnya SO2).
Logam, Separuh Logam dan Bukan Logam
- Apabila merentasi kala daripada kiri ke kanan, unsur-unsur berubah daripada logam kepada bukan logam.
- Terdapat juga 7 unsur di dalam Jadual Berkala digolongkan sebagai separuh logam.
- Unsur-unsur logam biasanya terletak di sebelah kri Jadual berkala manakala unsur-unsur bukan logam terletak di sebelah kanan.
- Unsur-unsur separuh logam biasanya terletak di antara logam dan bukan logam dalam satu kala.
Kegunaan Separuh Logam
- Unsur-unsur separuh logam yang paling lazim digunakan di dalam industri ialah silikon dan germanium.
- Ia digunakan untuk membuat diod dan transistor dalam industri elektronik.
Electronegativity
- Keelektronegatifan suatu unsur ialah suatu ukuran kebolehan atom unsur itu untuk menarik elektron ke arahnya dalam suatu molekul.
- Unsur-unsur logam mempunyai keelektronegatifan yang rendah manakala unsur-unsur bukan logam mempunyai keelektronegatifan yang tinggi.
- Keelektronegatifan bagi unsur semakin bertambah apabila merentasi suatu kala dari kiri ke kanan.
- Ini adalah kerana apabila merentasi kala
- cas positif semakin bertambah.
- Maka kekuatan nukleus atom untuk menarik elektron turut bertambah
- Dengan ini keelektronegatifan bertambah.